解:(1)設(shè)需這種濃硫酸的質(zhì)量為x,
根據(jù)稀釋前后溶質(zhì)的質(zhì)量不變可得:
100g×19.6%=x×98%
解得:x=20g.
(2)設(shè)6.5g鋅完全反應(yīng)生成氫氣的質(zhì)量為y,
Zn+H
2SO
4=ZnSO
4+H
2↑
65 2
6.5g y
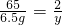
,
解得:y=0.2g.
答:需這種濃硫酸20g;可制得氫氣0.2g.
分析:(1)利用溶質(zhì)質(zhì)量=溶液質(zhì)量×溶液的溶質(zhì)質(zhì)量分?jǐn)?shù),再根據(jù)稀釋前后溶質(zhì)的質(zhì)量不變即可求出所需濃硫酸的質(zhì)量.
(2)根據(jù)充分反應(yīng)消耗的6.5g鋅,根據(jù)反應(yīng)的化學(xué)方程式,列比例式即可計算出可制取氫氣的質(zhì)量.
點評:根據(jù)反應(yīng)的化學(xué)方程式可以表示反應(yīng)中各物質(zhì)的質(zhì)量關(guān)系,由反應(yīng)中某一物質(zhì)的質(zhì)量可計算反應(yīng)中其它物質(zhì)的質(zhì)量.

 實驗室中濃硫酸的商標(biāo)如右圖所示:根據(jù)有關(guān)信息計算:
實驗室中濃硫酸的商標(biāo)如右圖所示:根據(jù)有關(guān)信息計算: ,
,

 實驗室中濃硫酸的商標(biāo)如右圖所示:根據(jù)有關(guān)信息計算:
實驗室中濃硫酸的商標(biāo)如右圖所示:根據(jù)有關(guān)信息計算: 19、實驗室中濃硫酸的商標(biāo)如圖所示,根據(jù)有關(guān)信息計算:(精確到0.1)
19、實驗室中濃硫酸的商標(biāo)如圖所示,根據(jù)有關(guān)信息計算:(精確到0.1)