分析:(1)根據加水稀釋前后溶液中溶質質量不變,由所要配制的稀鹽酸中所含溶質的質量,利用標簽中標注的濃鹽酸的質量分數,可計算需用濃鹽酸的體積;
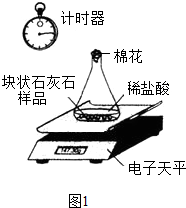
(2)①根據測定實驗的操作示意圖及所得關系曲線,判斷實驗過程中所要記錄的數據;
②對比等質量的兩種固體形狀不同的石灰石隨反應時間增加所放出二氧化碳的曲線,判斷石灰石形狀對反應速率的影響;
③由完全反應所放出的二氧化碳,根據反應的化學方程式,計算反應所消耗碳酸鈣的質量,求出樣品中碳酸鈣的質量分數.
解答:解:(1)設需用鹽酸的體積為x
1000g×14.6%=x×1.18g/cm
3×36%
x=343.7cm
3答:需用這種鹽酸343.7毫升.
(2)①根據操作示意圖,實驗過程中對錐形瓶內所剩余物質的質量進行稱量,由此得到反應時間與放出二氧化碳的質量關系,即連續記錄的實驗數據是:電子天平示數(或錐形瓶體系質量)和計時器示數(或反應時間);
②根據釋放出二氧化碳的質量與反應時間的關系圖,不難觀察到:相同的反應時間內塊狀石灰石反應所產生二氧化碳的質量小于粉末狀的石灰石;粉末狀石灰石與鹽酸的接觸要比塊狀石灰石更充分,所以,可得到當其他條件相同時,接觸面積越大(或小),其反應速度越快(或慢);
故答案為:
①電子天平示數(或錐形瓶體系質量),計時器示數(或反應時間)
②大,快(或小,慢)
③設每份樣品中CaCO
3的質量為y
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 44
y 3.85g
=
x=8.75g
20.00g÷2=10.00g
樣品中CaCO
3質量分數=
×100%=87.5%
答:樣品中CaCO
3質量分數為87.5%.
點評:本題是借助于數學模型,利用圖表的方式來分析和解決化學計算中的有關問題,要求學生有較強的識圖能力和數據分析能力.