
【題目】某廠以甘蔗為原料制糖,對產生的大量甘蔗渣按如圖所示轉化進行綜合利用(部分反應條件及產物沒有列出)。
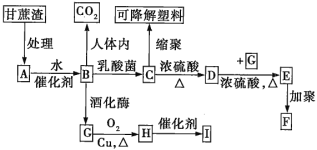
其中B是A水解的最終產物;C的分子式為C3H6O3,一定條件下2個C分子分子間脫去2分子水可生成一種六元環狀化合物;D可使溴水褪色;H的三聚物I也是一種六元環狀化合物。
提示:葡萄糖在乳酸菌作用下生成乳酸(![]() )。
)。
(1)C→D的反應類型為__,D→E的反應類型為__。
(2)寫出A→B反應的化學方程式:_。
(3)H分子中所含官能團的名稱是__,實驗室中常用于檢驗該官能團的試劑的名稱是_(只寫一種)。
(4)寫出下列物質的結構簡式:高分子化合物F__;六元環狀化合物I_。
【答案】消去反應 酯化反應(或取代反應) ![]() 醛基 新制的Cu(OH)2懸濁液(或銀氨溶液)
醛基 新制的Cu(OH)2懸濁液(或銀氨溶液) 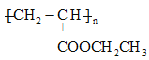
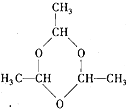
【解析】
甘蔗渣處理之后得到A為纖維素,纖維素水解的最終產物B為葡萄糖,葡萄糖在酒化酶的作用下生成G為CH3CH2OH,G催化氧化生成H為CH3CHO,H的三聚合物I也是一種六元環狀化合物,I應為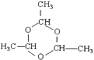 ,葡萄糖在乳酸菌的作用下生成C為乳酸,即CH3CHOHCOOH,由E能發生加聚反應可知C生成D的反應為消去反應,則D為CH2=CHCOOH,E為丙烯酸和乙醇發生酯化反應生成的酯,為CH2=CHCOOCH2CH3,F為
,葡萄糖在乳酸菌的作用下生成C為乳酸,即CH3CHOHCOOH,由E能發生加聚反應可知C生成D的反應為消去反應,則D為CH2=CHCOOH,E為丙烯酸和乙醇發生酯化反應生成的酯,為CH2=CHCOOCH2CH3,F為![]() ,結合有機物的結構和性質以及題目要求可解答該題。
,結合有機物的結構和性質以及題目要求可解答該題。
(1)根據上述分析知,C生成D的反應為消去反應,E為丙烯酸和乙醇發生酯化反應生成的酯,故答案為:消去反應;酯化反應(或取代反應);
(2)A→B為纖維素的水解,反應的化學方程式為![]() ;
;
(3)H為CH3CHO,含-CHO,實驗室中常用于檢驗H中的官能團的試劑名稱新制的Cu(OH)2(或銀氨溶液),故答案為:醛基;新制的Cu(OH)2懸濁液(或銀氨溶液);
(4)由以上分析可知F為![]() ,I為
,I為 。
。


 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案 新黃岡兵法密卷系列答案
新黃岡兵法密卷系列答案科目:高中化學 來源: 題型:
【題目】Li4Ti5O12和LiFePO4都是鋰離子電池的電極材料,可利用鈦鐵礦(主要成分為FeTiO3,還含有少量MgO、SiO2等雜質)來制備,工藝流程如下:
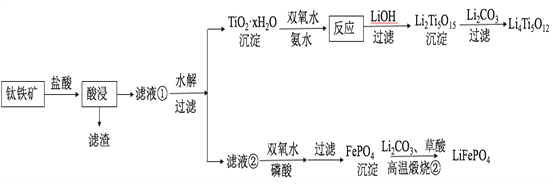
回答下列問題:
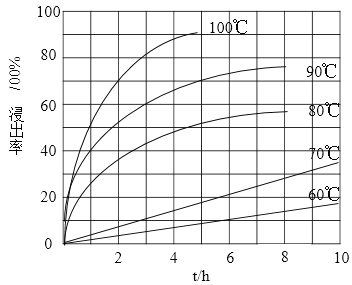
(1)“酸浸”實驗中,鐵的浸出率結果如下圖所示。由圖可知,當鐵的凈出率為70%時,所采用的實驗條件為___________________。
(2)“酸浸”后,鈦主要以TiOCl42-形式存在,寫出相應反應的離子方程式__________________。
(3)TiO2·xH2O沉淀與雙氧水、氨水反應40 min所得實驗結果如下表所示:
溫度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O轉化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃時TiO2·xH2O轉化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合價為+4,其中過氧鍵的數目為__________________。
(5)若“濾液②”中c(Mg2+)=0.02 mol/L,加入雙氧水和磷酸(設溶液體積增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此時是否有Mg3(PO4)2沉淀生成?___________(列式計算)。
FePO4、Mg3(PO4)2的Ksp分別為1.3×10-22、1.0×10-24。
(6)寫出“高溫煅燒②”中由FePO4制備LiFePO4的化學方程式______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制取少量溴乙烷的裝置如圖所示,將生成物導入盛有冰水混合物的試管a中,實驗結束發現試管a中的物質分為三層.對該實驗的分析錯誤的是( )
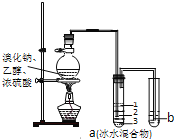
A. 燒瓶中除發生取代反應可能發生消去反應、氧化還原反應等
B. 產物在a中第一層
C. a中有產物和水還含HBr、CH3CH2OH等
D. b中盛放的酸性KMnO4溶液會褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是
A. 除去乙醇中的少量水,方法是加入新制生石灰,經過濾后即得乙醇
B. HOCH2CH(CH3)2與(CH3)3COH屬于碳鏈異構
C. 除去乙酸乙酯中的乙酸和乙醇雜質,可加入足量燒堿溶液,通過分液即得乙酸乙酯
D. 一個苯環上已經連有-CH3、-CH2CH3、-OH三種基團,如果在苯環上再連接一個-CH3,其同分異構體有16種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知單質硫16 g燃燒放熱為149 kJ,寫出硫燃燒熱的熱化學方程式:_________________
(2)依據蓋斯定律可以對某些難以通過實驗直接測定的化學反應的焓變進行推算。
已知: C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol③
根據蓋斯定律,計算298 K時由C(石墨,s)和H2(g)生成1 mol C2H2(g)反應的焓變:_____________。
(3)已知:N2、O2分子中化學鍵的鍵能分別是946 kJ/mol、497 kJ/mol。 N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol,NO分子中化學鍵的鍵能為_____ kJ/mol。
(4)S(單斜)和S(正交)是硫的兩種同素異形體。
已知:①S(單斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol;
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol;
③S(單斜,s)=S(正交,s) ΔH3=_____。
S(單斜,s)比S(正交,s)更_________(填“穩定”或“不穩定”)
(5)同溫同壓下,H2(g)+Cl2(g)=2HCl(g),在光照和點燃條件下的ΔH(化學計量數相同)分別為ΔH1 、ΔH2,則ΔH1___________ΔH2。(用“>”、“<”或“=”填空)
(6)相同條件下,2 mol氫原子所具有的能量________1 mol 氫分子所具有的能量。(用“>”、“<”或“=”填空)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦及其化合物在化工、醫藥、材料等領域有著廣泛的應用。
(1)基態鈦原子的價電子排布式為_____________,與鈦同周期的元素中,基態原子的未成對電子數與鈦相同的有____________種。
(2)鈦比鋼輕、比鋁硬,是一種新興的結構材料,鈦的硬度比鋁大的原因是_________。
(3)在濃的TiCl3的鹽酸溶液中加入乙醚,并通入HCl至飽和,可得到配位數為6、組成為TiCl3·6H2O的綠色晶體,該晶體中兩種配體的物質的量之比為1:5,則該配合離子的化學式為___________。
(4)半夾心結構催化劑M能催化乙烯、丙烯、苯乙烯的聚合,其結構如下圖所示。
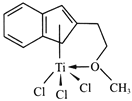
①組成M的元素中,電負性最大的是_________(填名稱)。
②M中碳原子的雜化方式為____________。
③M中不含________(填代號)。
a.π鍵 b.σ鍵 c.離子鍵 d.配位鍵
(5)金紅石(TiO2)是含鈦的主要礦物之一。其晶胞結構(晶胞中相同位置的原子相同)如圖所示。

①A、B、C、D 4種微粒,其中氧原子是________(填代號)。
②若A、B、C的原子坐標分別為A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),則D的原子坐標為D(0.19a,____,___);鈦氧鍵的鍵長d=______(用代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列敘述正確的是( )
A.pH=a的氨水,稀釋10倍后,其pH=b,則a<b+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl溶液恰好無色,則此時溶液的pH<7
C.向10mL0.1mol·L-1的CH3COOH溶液中滴加相同濃度的氨水,在滴加過程中,![]() 將減小
將減小
D.向10mLpH=11的氨水中加入10mLpH=3的H2SO4溶液,混合液pH=7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及導電性變化如圖。
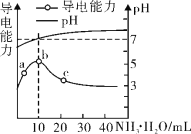
下列分析正確的是
A.HR為強酸
B.加入10 mL 氨水時,溶液中c(NH4+)>c(R-)
C.c點溶液存在c(NH4+)<c( R-)
D.b點的離子濃度大于a點的離子濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PVAc是一種具有熱塑性的樹脂,可合成重要的高分子材料![]() ,合成路線如下:
,合成路線如下:
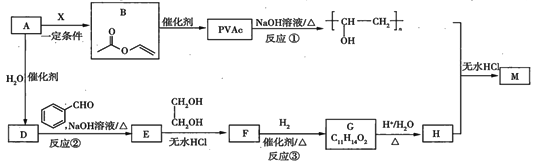
已知:
Ⅰ.![]() ;
;
Ⅱ.RCHO+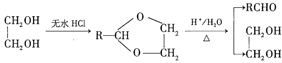
(1)標準狀況下,![]() 氣態烴
氣態烴![]() 的質量是5.2g,則
的質量是5.2g,則![]() 的結構簡式為___________。
的結構簡式為___________。
(2)已知![]() 為加成反應,則
為加成反應,則![]() 的結構簡式為_______;
的結構簡式為_______;![]() 中所含官能團的名稱是__________。
中所含官能團的名稱是__________。
(3)反應①的化學方程式為__________________。
(4)反應③的化學方程式為__________________。
(5)在![]() 的轉化過程中,乙二醇的作用是________________。
的轉化過程中,乙二醇的作用是________________。
(6)已知![]() 的鏈節中除苯環外,還含有六元環狀結構,則
的鏈節中除苯環外,還含有六元環狀結構,則![]() 的結構簡式為____________。
的結構簡式為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com