
【題目】已知某純堿試樣中含有NaCl雜質,為測定試樣中純堿的質量分數,可用下圖中的裝置進行實驗。
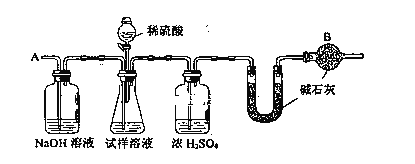
主要實驗步驟如下:
① 按圖組裝儀器,并檢驗裝置的氣密性
② 將a g試樣放入錐形瓶中,加適量蒸餾水溶解,得到試樣溶液
③ 稱量盛有堿石灰的U型管的質量,得到b g
④ 從分液漏斗滴入6mol·L—1的硫酸,直到不再產生氣體時為止
⑤ 從導管A處緩緩鼓入一定量的空氣
⑥ 再次稱量盛有堿石灰的U型管的質量,得到c g
⑦ 重復步驟⑤和⑥的操作,直到U型管的質量基本不變,為d g
請回答下列有關問題:
(1)在用托盤天平稱量樣品時,如果天平的指針向左偏轉,說明________________。
(2)裝置中干燥管B的作用是______________________________________________。
(3)如果將分液漏斗中的硫酸換成濃度相同的鹽酸,測試的結果_________。(選填偏高、偏低或不變)。
(4)步驟⑤的目的是__________________________________________。
(5)步驟⑦的目的是__________________________________________。
(6)試樣中純堿的質量分數的計算式為__________________________。
(7)寫出純堿與稀硫酸反應的離子方程式為________________________。
【答案】樣品重,砝碼輕 防止空氣中的CO2和水氣進入U型管中 偏高 把反應產生的CO2全部導入U形管中 判斷反應產生的CO2是否全部排出,并被U形管中的堿石灰吸收 ![]() ×100% CO32-+2H+= CO2↑+H2O
×100% CO32-+2H+= CO2↑+H2O
【解析】
(1)根據天平稱量時按照左物右碼的原則考慮;
(2)由于空氣中也有二氧化碳和水分,干燥管B的作用就是不讓它們進入的;
(3)根據鹽酸的揮發性考慮;
(4)由于反應結束后錐形瓶中存留有二氧化碳,鼓入一定量的空氣就是為了驅趕它們的;
(5)就是為了將二氧化碳全部趕過去;
(6)根據U型管的質量的增加量就是生成的二氧化碳的質量,根據二氧化碳的質量算出碳酸鈉的質量,再用碳酸鈉的質量除以樣品質量即可。
(7) 純堿與硫酸反應生成硫酸鈉、二氧化碳和水,純堿與硫酸均為強電解質,寫化學式。
(1)由于稱量時左物右碼,向左偏說明樣品重,砝碼輕;
(2)U型管中的堿石灰是為了吸收反應生成的二氧化碳,但空氣中也存在二氧化碳,干燥管B的作用就是防止空氣中的二氧化碳和水分進入U型管,對結果產生誤差;
(3)由于鹽酸具有揮發性,也會隨著二氧化碳進入U型管,被誤認為是二氧化碳,所以二氧化碳的質量偏大,算出的碳酸鈉的質量也會偏大的,所以結果會偏高;
(4)由于反應結束后錐形瓶中存留有二氧化碳,鼓入一定量的空氣就是將殘留的二氧化碳完全排入U型管;
(5)直到U型管的質量基本不變,說明二氧化碳已經被全部排到U型管中,步驟⑦的目的是:判斷反應產生的CO2是否全部排出,并被U形管中的堿石灰吸收;
(6)設需要碳酸鈉的質量為m則:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
m db
列比例式解得:m=![]() ,所以試樣中純堿的質量分數的計算式=
,所以試樣中純堿的質量分數的計算式=![]() ×100%;
×100%;
(7)純堿與硫酸反應生成硫酸鈉、二氧化碳和水,純堿與硫酸均為強電解質,寫化學式,則離子方程式為CO32-+2H+= CO2↑+H2O。


科目:高中化學 來源: 題型:
【題目】下列實驗設計及其對應的離子方程式均正確的是( )
A.用FeCl3溶液腐蝕銅線路板:Cu+2Fe3+→Cu2++2Fe2+
B.Na2O2與H2O反應制備O2:Na2O2+H2O→2Na++2OH-+O2↑
C.將氯氣溶于水制備次氯酸:Cl2+H2O→2H++Cl-+ClO-
D.鐵與鹽酸反應:2Fe + 6H+→2Fe3++3H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷是天然氣的主要成分,是一種高效、低耗、污染小的清潔能源。下列說法正確的是( )
①甲烷是一種正四面體結構的分子
②物質的量1:1的甲烷與氯氣發生取代反應時,生成物只有CH3Cl和HCl
③0.5 mol甲烷完全燃燒時消耗氧氣最多為1 mol
④1 mol甲烷全部生成CCl4,最多消耗2 mol氯氣
A.①②B.①③C.②④D.③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關硅及其化合物的說法正確的是( )
A.陶瓷、玻璃、水泥容器都能貯存氫氟酸
B.硅酸鈉屬于鹽,不屬于堿,所以硅酸鈉可以保存在具有磨口玻璃塞的試劑瓶中
C.用![]() 制取硅酸,應先使二氧化硅與氫氧化鈉溶液反應,然后再通過
制取硅酸,應先使二氧化硅與氫氧化鈉溶液反應,然后再通過![]()
D.由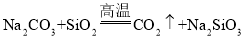 可知,硅酸的酸性強于碳酸
可知,硅酸的酸性強于碳酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵鉻氧化還原液流電池是一種低成本的儲能電池,電池結構如圖所示,工作原理為Fe3++Cr2+![]() Fe2++Cr3+。下列說法一定正確的是
Fe2++Cr3+。下列說法一定正確的是
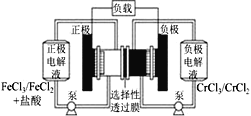
A.放電時,正極的電極反應式為Cr2+-e-=Cr3+
B.電池充電時,陰極的電極反應式為Fe2+-e-=Fe3+
C.電池放電時,Cl-從正極室穿過選擇性透過膜移向負極室
D.放電時,電路中每流過0.1 mol電子,Cr3+濃度增加0.1 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家從化肥廠生產的![]() 中檢出組成為
中檢出組成為![]() 的物質,經測定,該物質易溶于水,在水中以
的物質,經測定,該物質易溶于水,在水中以![]() 和
和![]() 兩種離子形式存在,植物的根系易吸收
兩種離子形式存在,植物的根系易吸收![]() ,但它遇到堿時,會生成一種形似白磷的
,但它遇到堿時,會生成一種形似白磷的![]() 分子,
分子,![]() 分子不能被植物吸收。
分子不能被植物吸收。
請回答下列問題:
![]() 和
和![]() 的關系正確的是 ______
的關系正確的是 ______ ![]() 填序號
填序號![]() 。
。
A.同種單質![]() 同位素
同位素![]() 同分異構體
同分異構體![]() 同素異形體
同素異形體
![]() ______
______ ![]() 填“能”或“不能”
填“能”或“不能”![]() 和草木灰混合施用。
和草木灰混合施用。
![]() 已知斷裂
已知斷裂![]() 吸收167kJ熱量,生成1molN
吸收167kJ熱量,生成1molN![]() N放出
N放出![]() 的熱量,寫出
的熱量,寫出![]() 氣體轉變為
氣體轉變為![]() 的熱化學方程式: ______ 。
的熱化學方程式: ______ 。
![]() 已知白磷、
已知白磷、![]() 、
、![]() 的空間構型均為四面體,
的空間構型均為四面體,![]() 的結構式為
的結構式為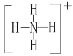 ,白磷
,白磷![]() 的結構式為
的結構式為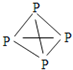 ,請畫出
,請畫出![]() 的結構式 ______ 。
的結構式 ______ 。
![]() 已知液氨中存在著平衡
已知液氨中存在著平衡![]() ,科學家在液氨中加入氫氧化銫
,科學家在液氨中加入氫氧化銫![]() 和特殊的吸水劑,使液氨中的
和特殊的吸水劑,使液氨中的![]() 生成
生成![]() 分子和另一種單質氣體,請寫出液氨與氫氧化銫反應的化學方程式: ______ 。
分子和另一種單質氣體,請寫出液氨與氫氧化銫反應的化學方程式: ______ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于![]() 的說法中正確的是
的說法中正確的是
A. 所有原子都可能在同一平面上
B. 最多只可能有9個碳原子在同一平面上
C. 有7個碳原子可能在同一直線上
D. 分子中有5個碳原子在同一直線上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酰苯胺作為一種常用藥,具有解熱鎮痛的效果。實驗室制備乙酰苯胺時,可以用苯胺與乙酸酐加熱來制取,該反應放熱:
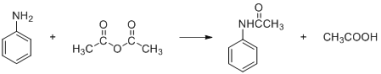
密度(g/mL) | 相對分子質量 | 顏色、狀態 | 溶解性 | |
苯胺 | 1.04 | 93 | 無色油狀液體 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 無色透明液體 | 遇水緩慢反應生成乙酸 |
乙酰苯胺 | 135 | 無色片狀晶體, 熔點 114℃ | 不溶于冷水,可溶于熱 水、乙醇、乙醚 |
實驗步驟
①取5.00 mL苯胺,倒入100 mL錐形瓶中,加入20 mL水,在旋搖下分批加入6.00 mL 乙酸酐,攪拌均勻。若有結塊現象產生,用玻璃棒將塊狀物研碎,再充分攪拌;
②反應完全后,及時把反應混合物轉移到燒杯中,冷卻后,抽濾,洗滌,得粗乙酰苯胺固體;
③將粗產品轉移至150 mL燒杯中,加入適量水配制成 80 ℃的飽和溶液,再加入過量20%的水。稍冷后,加半匙活性炭,攪拌下將溶液煮沸3~5 min,_______,冷卻結晶,抽濾、洗滌、晾干得乙酰苯胺純品6.2 g。
請回答:
(1)反應溫度過高會導致苯胺揮發,下列操作可控制反應溫度,防止反應溫度升高過快的是______。
A 加20 mL水 B 旋搖下分批加入6.0 mL乙酸酐
C 玻璃棒將塊狀物研碎 D 充分攪拌
(2)在步驟②中對粗產品進行洗滌需要用到以下操作:
a 加入洗滌劑至浸沒固體;b 洗滌劑緩慢通過;c 關小水龍頭;d 開大水龍頭; e 重復 2~3 次。
請對以上操作做出正確的排序__________。
(3)步驟③加入過量 20%的水的目的是________,橫線處的操作步驟是_________。
(4)下列說法不正確的是______。
A 活性炭吸附有色物質,可以提高產率
B 冷卻時,室溫冷卻比冰水浴冷卻更易得到大顆粒晶體便于抽濾
C 抽濾用如圖裝置,為防止倒吸,結束時可先關閉水龍頭,后打開活塞a
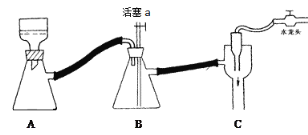
D 產品可放在表面皿上用熱水浴烘干,烘干后可通過測量產品熔點判斷產品純度
(5)該實驗的產率是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去粗鹽中的雜質 CaCl2、MgCl2 和 Na2SO4,過程如下:
![]()
下列有關說法中,不正確的是( )
A. 除去 Mg2+的主要反應: Mg2++ 2OH-=Mg(OH)2↓
B. 試劑①一定不是Na2CO3溶液
C. 檢驗 SO42-是否除凈:取少量濾液,加稀鹽酸酸化,再加 BaCl2 溶液
D. 濾液加稀鹽酸時只發生反應:H+ +OH- =H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com