
(1)如下圖所示,組成一種原電池.試回答下列問題(燈泡功率合適):
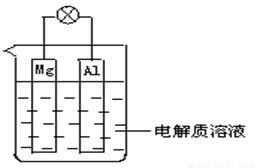
①電解質溶液為稀H2SO4時上述裝置中燈泡亮,此時Al電極上發生反應的電極反應式為: ___ ;
②電解質溶液為NaOH溶液時,燈泡__________(填“亮”或“不亮”, 填“亮”做a題,填“不亮”做b題)。
a.若燈泡亮,則Al電極上發生反應的電極反應式為:_______________ ;
b.若燈泡不亮,其理由為:________________________ 。
(2)原電池原理的應用之一是可以設計原電池。請利用反應“Cu+2Fe3+ =2Fe2+ +Cu2+ ”設制一個原電池(正極材料用碳棒)則該電池的負極材料是 ,正極上發生反應的電極反應式 ;若導線上轉移電子1.5 mol,則溶解銅的質量是 。另外的重要應用是實驗室在用鋅與稀硫酸反應制備氫氣時,可向溶液中滴加少量硫酸銅溶液,其作用是: 。
(共11分) (1)①2H+ + 2e- H2↑;(2分)
H2↑;(2分)
②亮 (1分) a.
Al + 4OH- [Al(OH)4]-
+ 3e-(2分)
[Al(OH)4]-
+ 3e-(2分)
(2)Cu(1分) ;Fe3+ + e- Fe2+(2分) 48g(2分);
Fe2+(2分) 48g(2分);
形成了Zn—Cu原電池,加快了化學反應的速率(注:必須強調形成Zn—Cu原電池,否則不得分)(1分) ;
【解析】
試題分析:(1)①鎂的金屬性強于鋁的,所以在該原電池中鎂是負極,失去電子。鋁是正極,溶液中的氫離子在正極得到電子,正極電極反應式是2H+ + 2e- H2↑。
H2↑。
②由于鋁能和氫氧化鈉溶液反應,所以電解質溶液為NaOH溶液時仍然構成原電池,燈泡亮。但此時鋁是負極,失去電子,鎂是正極。負極電極反應式是Al + 4OH- [Al(OH)4]-
+ 3e-。
[Al(OH)4]-
+ 3e-。
(2)原電池中較活潑的金屬是負極,失去電子,發生氧化反應。電子經導線傳遞到正極,所以溶液中的陽離子向正極移動,正極得到電子,發生還原反應,。所以根據方程式可知,銅失去電子,做還原劑,則銅是負極。鐵離子得到電子,是氧化劑,則電解質溶液是含有鐵離子的可溶性鹽溶液,正極材料可以是石墨或活潑性弱于銅的金屬,正極上發生反應的電極反應式Fe3+ + e- Fe2+。若導線上轉移電子1.5
mol,則溶解銅的物質的量是1.5mol÷2=0.75mol,質量是0.75mol×64g/mol=48g。加入硫酸銅后,鋅置換出銅,形成了Zn—Cu原電池,加快了化學反應的速率。
Fe2+。若導線上轉移電子1.5
mol,則溶解銅的物質的量是1.5mol÷2=0.75mol,質量是0.75mol×64g/mol=48g。加入硫酸銅后,鋅置換出銅,形成了Zn—Cu原電池,加快了化學反應的速率。
考點:考查原電池的有關判斷、應用和計算
點評:該題是高考中的常見題型,屬于中等難度的試題。試題貼近高考,基礎性強,注重答題的靈活性。側重對學生靈活運用原電池原理解決實際問題的能力的培養,有利于調動學生的學習興趣和學習積極性。明確原電池的工作原理并能結合題意和裝置圖靈活運用是解題的關鍵。易錯點是選項(1)②中電極的判斷。


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:閱讀理解
| 氧氣 |
| △ |
| 稀H2SO4 |
| 硫酸亞鐵 |
| 硝酸銀 |
| 氫氧化鈉 |
| 稀硫酸 |
| 濃H2SO4 |
| △ |
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 試驗序號 | 實驗步驟 | 實驗現象 | 結論 |
| ① | 取少量該焰火原料, 加入冷水 |
無明顯現象 | 合金中不含Li、Na等活潑金屬 |
| ② | 取少量該焰火原料, 加入足量稀鹽酸 |
完全溶解,有大量氣體 產生、溶液呈無色 |
含有能與鹽酸反應的較活潑的金屬 含有能與鹽酸反應的較活潑的金屬 |



查看答案和解析>>
科目:高中化學 來源: 題型:
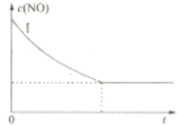 利用催化劑可使NO和CO發生反應:2NO(g)+2CO(g)═2CO2(g)+N2(g)△H<0.已知增大催化劑的比表面積可提高化學反應速率.為了分別驗證溫度、催化劑的比表面積對化學反應速率的影響規律,某同學設計了三組實驗,部分實驗條件已經填在線面實驗設計表中.
利用催化劑可使NO和CO發生反應:2NO(g)+2CO(g)═2CO2(g)+N2(g)△H<0.已知增大催化劑的比表面積可提高化學反應速率.為了分別驗證溫度、催化劑的比表面積對化學反應速率的影響規律,某同學設計了三組實驗,部分實驗條件已經填在線面實驗設計表中.| 實驗編號 | t(℃) | NO初始濃度(mol/L) | CO初始濃度(mol/L) | 催化劑的比表面積(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 1.20×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
查看答案和解析>>
科目:高中化學 來源: 題型:
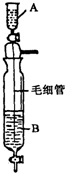 在Inorganic Syntheses一書中,有一裝置是用以制備某種干燥的純凈氣體,如下圖所示:其A中應盛放一種密度比B中密度小的液體.下表中為幾種液體的密度
在Inorganic Syntheses一書中,有一裝置是用以制備某種干燥的純凈氣體,如下圖所示:其A中應盛放一種密度比B中密度小的液體.下表中為幾種液體的密度| 溶液名稱 | 濃鹽酸 | 濃硫酸 | 濃氨水 | 濃氫氧化鈉溶液 | 濃醋酸 |
| 密度(g/mL) | 1.19 | 1.84 | 0.89 | 1.41 | 1.06 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com