
【題目】如圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容。據此下列說法正確的是

A. 該硫酸的物質的量濃度為9.2mo1/L
B. 該硫酸與等體積的水混合所得溶液的質量分數為49%
C. 配制250mL 4.6mo1/L的稀硫酸需取該硫酸62.5mL
D. 該硫酸與等質量的水混合所得溶液的物質的量濃度大于9.2mo1/L
【答案】C
【解析】
A.該硫酸的物質的量濃度為:c=1000ρw%/M=(1000×1.84×98%/98)mol/L=18.4mol/L,故A項錯誤;
B.硫酸與等體積的水混合,體積變為原來的2倍,由于混合后密度減小,所以混合后的質量小于原硫酸質量的2倍,原硫酸中溶質的質量分數為 98%,故混合后溶液的質量分數大于49%,故B項錯誤;
C.根據稀釋定律,稀釋前后溶質的物質的量不變,設濃硫酸的體積為xmL,則xmL×18.4mol/L=250mL×4.6mol/L,計算得出:x=62.5,所以應量取的濃硫酸體積是62.5mL,故C項正確;
D. 硫酸與等質量的水混合,混合后溶液的質量為原硫酸的2倍,稀釋后溶液的密度減小,故稀釋后所得溶液的體積大于原硫酸體積的2倍,則稀釋后所得溶液的濃度小于9.2mol/L,故D項錯誤;
綜上,本題選C。


科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是




甲 乙 丙 丁
A. 圖甲表示常溫下稀釋pH均為11的MOH溶液和NOH溶液時pH的變化,由圖可知溶液的堿性:MOH>NOH
B. 圖乙表示常溫下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲線
C. 圖丙表示反應CH4(g)+H2O (g)![]() CO(g)+3H 2(g)的能量變化,使用催化劑可改變Eb﹣Ea的值
CO(g)+3H 2(g)的能量變化,使用催化劑可改變Eb﹣Ea的值
D. 圖丁表示反應2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他條件不變時,改變起始CO的物質的量,平衡時N2的體積分數變化,由圖可知NO的轉化率c>b>a
N2(g)+2CO2(g),在其他條件不變時,改變起始CO的物質的量,平衡時N2的體積分數變化,由圖可知NO的轉化率c>b>a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖轉化關系中的物質均為常見物質或它們的溶液,其中 A、C 為單質,B 為氧化物且常溫下為無色液體,E 為淡黃色固體,H 為紅褐色沉淀。(反應條件和部分產物已省略)

根據上述轉化關系,回答問題:
(1)寫出下列物質的化學式:A_________ G _________
(2)反應①的化學方程式為:______________________________________。反應②的離子方程式為:______________________________________。
(3)沉淀 G 轉化為沉淀 H 的現象:________,化學方程式為___________
(4)寫出物質 E 的一種用途________________________________。
(5)一定條件下,將一定量的 A 與足量的 C 充分反應,最終得到 39.0g 固體 E,則反應中轉移的電子數為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把NaOH、MgCl2、AlCl3三種固體組成的混合物溶于足量水中后有1.16g白色沉淀,在所得的懸獨液中逐滴加入1mol·L-1HCl溶液,加入HCl溶液的體積V與生成沉淀的質量m的關系如圖所示。試回答:
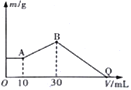
(1)A點沉淀物的化學式為_____________,
(2)AlCl3的物質的量為________________。
(3)HCl溶液在Q點的加入量是_________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 氫氧燃料電池放電時化學能全部轉化為電能
B. 反應4Fe(s)+3O2(g)![]() 2Fe2O3(s)常溫下可自發進行,該反應為吸熱反應
2Fe2O3(s)常溫下可自發進行,該反應為吸熱反應
C. 3 mol H2與1 mol N2混合反應生成NH3,轉移電子的數目小于6×6.02×1023
D. 在酶催化淀粉水解反應中,溫度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向 0.1mo1·L-1 的 H2SO4 溶液中滴入 0.1mo1·L-1 過量的 Ba(OH)2 溶液,溶液的導電能力發生變化,其電流強度 (I) 隨加入 Ba(OH)2 溶液的體積 (V) 的變化曲線正確的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列圖像中,能正確表示上述反應的是(橫坐標表示加入NaOH溶液的體積,縱坐標表示反應生成沉淀的質量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NOx(主要指NO和NO2)是大氣主要污染物之一。有效去除大氣中的NOx是環境保護的重要課題。
(1)用水吸收NOx的相關熱化學方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反應3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,電解該混合溶液可獲得較濃的硝酸。寫出電解時陽極的電極反應式:____________________________________。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收過程中存在HNO2與(NH2)2CO生成N2和CO2的反應。寫出該反應的化學方程式:____________________________________。
(4)在有氧條件下,新型催化劑M能催化NH3與NOx反應生成N2。
①NH3與NO2生成N2的反應中,當生成1 mol N2時,轉移的電子數為__________mol。
②將一定比例的O2、NH3和NOx的混合氣體,勻速通入裝有催化劑M的反應器中反應(裝置見題20圖1)。

反應相同時間NOx的去除率隨反應溫度的變化曲線如題20圖2所示,在50~250 ℃范圍內隨著溫度的升高,NOx的去除率先迅速上升后上升緩慢的主要原因是____________________________;當反應溫度高于380 ℃時,NOx的去除率迅速下降的原因可能是___________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據題目要求,用化學語言回答問題。
(I)除去下列括號內的雜質通常采用的實驗方法是什么?將答案填在橫線上。
(1)CH3CH2OH(H2O)_____________________________________________________;
(2)![]() (NaCl)____________________________________________;
(NaCl)____________________________________________;
(3) ![]() (Br2)___________________________________________________。
(Br2)___________________________________________________。
(II)某有機物的實驗式為C2H6O,用質譜儀測定其相對分子質量,經測定得到如圖1所示的質譜圖;最后用核磁共振儀處理該有機物,得到如圖2所示的核磁共振氫譜圖。

試回答下列問題:
(1)該有機化合物的相對分子質量為________。
(2)請寫出該有機化合物的結構簡式________。
(III)有機物E(C3H3Cl3)是一種播前除草劑的前體,其合成路線如下。

已知D在反應⑤中所生成的E,其結構只有一種可能,E分子中有3種不同類型的氯(不考慮空間異構)。試回答下列問題:
(1)利用題干中的信息推測烴A的結構簡式為______________。烴A的同系物中,相對分子質量最小的烴發生加聚反應的化學方程式為____________________________。
(2)寫出下列反應的類型:反應①是____________,反應③是________。
(3)利用題干中的信息推測有機物D的名稱是______________。
(4)試寫出反應③的化學方程式:____________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com