
【題目】設NA是阿伏加德羅常數的值。下列說法錯誤的是
A.1 L 0.1 mol/L NH4 NO3溶液中含有氮原子總數為0.2 NA
B.7.8 g Na2 O2與水完全反應,轉移的電子數為0.2 NA
C.2.8 g CO和N2混合氣體中含有質子數為1.4 NA
D.標準狀況下,2. 24 L環丙烷中化學鍵數目為0.9 NA
【答案】B
【解析】
A.1 L 0.1 mol/L NH4NO3溶液中含有0.1mol NH4NO3,含有氮原子總數為0.2NA,故A正確;
B.7.8 g Na2O2的物質的量為![]() =0.1mol,與水反應的方程式為2Na2O2+ 2H2O = 4NaOH + O2↑,反應中只有Na2O2中O元素的化合價發生變化,反應中轉移2個電子,因此0.1molNa2O2完全反應轉移的電子數為0.1NA,故B錯誤;
=0.1mol,與水反應的方程式為2Na2O2+ 2H2O = 4NaOH + O2↑,反應中只有Na2O2中O元素的化合價發生變化,反應中轉移2個電子,因此0.1molNa2O2完全反應轉移的電子數為0.1NA,故B錯誤;
C.CO和N2的摩爾質量都是28g/mol,2.8 g CO和N2混合氣體的物質的量為0.1mol,CO和N2分子中含有的質子數都是14,則2.8 g CO和N2混合氣體中含有質子數為1.4NA,故C正確;
D.標準狀況下,2. 24 L環丙烷的物質的量=![]() =0.1mol,1個環丙烷分子中含有6個C-H和3個C-C,化學鍵總數為9,因此0.1mol環丙烷中化學鍵數目為0.9NA,故D正確;
=0.1mol,1個環丙烷分子中含有6個C-H和3個C-C,化學鍵總數為9,因此0.1mol環丙烷中化學鍵數目為0.9NA,故D正確;
故選B。


 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)在溶液中對生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),經測定25℃時各組分含量隨pOH變化情況如圖所示(Cl-沒有畫出),此溫度下,下列分析正確的是

A. HClO2的電離平衡常數的數值Ka=10-8
B. pOH=11時,ClO2-部分轉化成ClO2和Cl-離子的方程式為:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7時,溶液中含氯微粒的濃度大小為:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同濃度的HClO2溶液和NaClO2溶液等體積混合,則混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物![]() (甲)、
(甲)、![]() (乙)、
(乙)、![]() (丙)的分子式均為C8H8,下列說法正確的是
(丙)的分子式均為C8H8,下列說法正確的是
A. 甲的同分異構體只有乙和丙兩種 B. 甲、乙、丙均可與溴的四氯化碳溶液反應
C. 甲、乙、丙的二氯化物種數最少的是丙 D. 甲中所有原子一定處于同一平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下圖所得判斷正確的是( )
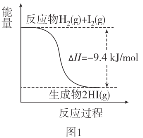
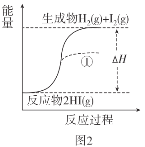
已知:I2(g)=I2(s) ΔH=-62.4kJ/mol
A.圖1反應為吸熱反應
B.圖2反應的熱化學方程式為2HI(g)![]() H2(g)+I2(g) ΔH=+9.4kJ/mol
H2(g)+I2(g) ΔH=+9.4kJ/mol
C.圖2中若I2的狀態為固態,則能量變化曲線可能為①
D.斷裂1molH2(g)和1molI2(g)中化學鍵需要的能量大于斷裂2molHI(g)中化學鍵需要的能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈷酸鋰(LiCoO2)可用作鋰離子電池的電極材料。以紅土鎳礦為原料制備LiCoO2的工藝流程如圖:
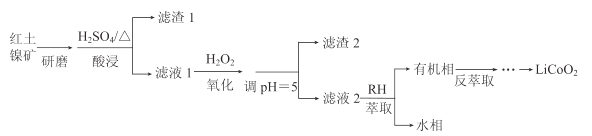
已知:①紅土鎳礦的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃時,生成氫氧化物沉淀的pH
離子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
開始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金屬離子起始濃度為0.1mol/L
(1)上述流程中能加快反應速率的措施有__。
(2)H2O2的作用是將Fe2+氧化為Fe3+。
①加入H2O2發生反應的離子方程式是__。
②濾渣2的主要成分是__(寫化學式)。
(3)萃取劑RH可用于對溶液中的Ni2+、Co2+進行分離與富集:Co2+(水相)+2RH(有機相)![]() CoR2(有機相)+2H+(水相)
CoR2(有機相)+2H+(水相)
①萃取劑濃度對溶液中Ni2+、Co2+的萃取率影響如圖所示,萃取劑濃度的最佳取值為__mol/L。
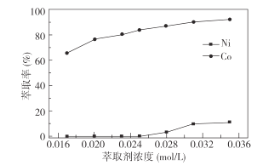
②在__(填“強堿性”或“強酸性”)介質中反萃取,使萃取劑再生而循環利用。
(4)向反萃取后的水溶液中加入稍過量NH4HCO3,得到CoCO3沉淀。將CoCO3與Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空氣,高溫燒結,得到Li2CoO2。
①得到CoCO3沉淀的離子方程式是__。
②若使用(NH4)2CO3做沉淀劑,產物中會混有Co2(OH)2CO3,這是因為__。
③在空氣中燒結反應的化學方程式是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用活性炭還原氮氧化物可防止空氣污染。向1L密閉容器加入一定量的活性炭和NO,某溫度下發生反應:
已知:①C(s)+2NO(g)![]() N2(g)+CO2 (g) ΔH
N2(g)+CO2 (g) ΔH
②C(s)+O2(g)![]() CO2 (g) ΔH1= -393.5 kJ/mol
CO2 (g) ΔH1= -393.5 kJ/mol
③N2(g)+O2(g)![]() 2NO(g) ΔH2= +180.5 kJ/mol
2NO(g) ΔH2= +180.5 kJ/mol
下列說法錯誤的是
A.ΔH= -574.0 kJ/mol
B.當容器內氣體密度不變時,反應①達到平衡狀態
C.反應③正反應的活化能大于180.5 kJ/mol
D.反應①達到平衡后,增大壓強平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鋅是制造鋅鋇白和鋅鹽的主要原料,也可用作木材的防腐劑等。用氧化鋅煙塵(主要成分為ZnO,還含有少量PbO、CuO、Fe2 O3、FeO等)生產ZnSO4·7H2O的流程如下:
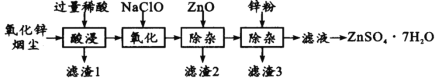
有關金屬離子[c(Mn+)= 0.l mol/L]形成氫氧化物沉淀的pH范圍如下表:
金屬離 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
開始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”時用的稀酸是____;濾渣1主要成分是____。
(2)“氧化”時的離子方程式為_________;加入ZnO除雜時溶液的pH控制范圍是____~5.0。
(3)濾渣3含有鋅和____;濾液得到ZnSO4·7H2O的操作是____、洗滌、干燥。
(4)取14.35gZnSO4·7H2O加熱至不同溫度,剩余固體的質量如下表
溫度/℃ | 100 | 250 | 680 | 930 |
質量/g | 8. 95 | 8. 05 | 6. 72 | 4.05 |
則680℃時剩余固體的化學式為________(填序號)。
A.ZnO B.Zn3O(SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2雜質),工業上用孔雀石制備硫酸銅的第一步需用過量的硫酸溶解并過濾常溫下,分別取濾液并向其中加入指定物質,反應后的溶液中主要存在的一組離子正確的是
A.加入過量氨水:Fe3+、![]() 、
、![]() 、OH-
、OH-
B.加入過量NaOH溶液:Na+、[Al(OH)4]-、![]() 、OH-
、OH-
C.加入過量H2O2溶液:Fe2+、H+、![]() 、Cu2+
、Cu2+
D.加入過量 NaHCO3溶液:Na+、Al3+、![]() 、
、![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以甲苯為原料合成某種食用香料(有機物G)和某種治療肺結核藥物的有效成分(有機物PASNa)的路線如下:
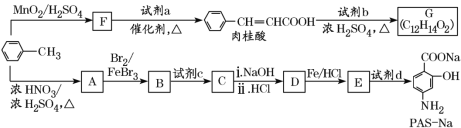
已知:①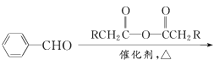
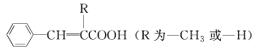
②![]()
③![]()
回答下列問題:
(1)肉桂酸中所含官能團的名稱是______________。
(2)①試劑a的結構簡式是________________。
②寫出由A生成B的化學方程式:____________________。
(3)已知試劑b為相對分子質量為60的醇,且無支鏈,寫出G的結構簡式:________________,由肉桂酸制取G的反應類型是________。
(4)①當試劑d過量時,可以選用的試劑d是_____(填字母)。
a.NaOH b.Na2CO3 c.NaHCO3
②參照題中信息,設計以![]() 為起始原料制備
為起始原料制備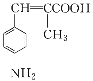 的合成路線。
的合成路線。
____________________。
(5)在肉桂酸分子中碳碳雙鍵催化加氫后得到化合物X(分子式為C9H10O2),X有多種同分異構體,符合下列條件的有________種。寫出其中一種處于對位且核磁共振氫譜中比例為6:1:2:2:1的結構簡式______________________________。
a.苯環上有兩個取代基
b.能發生銀鏡反應
c.與Na作用有H2產生
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com