
【題目】在一定條件下,向一帶活塞的密閉容器中充入2 mol SO2和1 mol O2,發生反應:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。達到平衡狀態后,在t1時刻改變條件,化學反應速率隨時間變化關系如圖所示。下列對t1時刻改變條件的推斷正確的是( )
2SO3(g) ΔH<0。達到平衡狀態后,在t1時刻改變條件,化學反應速率隨時間變化關系如圖所示。下列對t1時刻改變條件的推斷正確的是( )
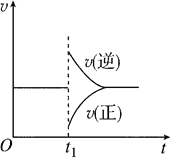
A. 保持壓強不變,升高反應溫度
B. 保持溫度不變,增大容器體積
C. 保持溫度和容器體積不變,充入1 mol SO3(g)
D. 保持溫度和壓強不變,充入1 mol SO3(g)
【答案】D
【解析】A、該反應是放熱反應,升高溫度,正逆反應速率都增大,正逆反應速率曲線都在原直線上方,逆反應速率增大倍數大于正反應速率增大的倍數,導致平衡向逆反應方向移動,故A錯誤;B、保持溫度不變,增大容器體積,導致容器內減小壓強,正逆反應速率都減小,即正逆反應速率曲線都在原直線的下方,正反應速率減小的倍數大于逆反應速率減小的倍數,導致平衡向逆反應方向移動,故B錯誤;C、保持溫度和容器體積不變,充入1molSO3(g)的瞬間,三氧化硫的濃度增大,二氧化硫和氧氣的濃度不變,所以逆反應速率大于正反應速率,所以正反應速率與原速率有接觸點,故C錯誤;D、保持溫度和壓強不變,充入1molSO3(g)的瞬間,容器的體積增大,導致生成物的濃度增大,反應物的濃度減小,逆反應速率大于正反應速率,平衡向逆反應方向移動,故D正確;故選D。


科目:高中化學 來源: 題型:
【題目】(1)琥珀酸亞鐵片是用于缺鐵性貧血的預防和治療的常見藥物,臨床建議服用維生素C促進“亞鐵”的吸收,避免生成Fe3+,從結構角度來看,Fe2+ 易被氧化成Fe3+的原因是____________。
(2)SCN-離子可用于Fe3+的檢驗,其對應的酸有兩種,分別為硫氰酸(H-S-C≡N)和異硫氰酸(H-N=C=S)。
①寫出與SCN-互為等電子體的一種微粒_________________(分子或離子);
②硫氰酸分子中π鍵和σ鍵的個數之比為___________;
③異硫氰酸的沸點比硫氰酸沸點高的原因是________________________。
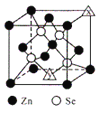
(3)硒化鋅的晶胞結構如圖所示,圖中X和Y點所堆積的原子均為___________(填元素符號);該晶胞中硒原子所處空隙類型為___________(填“立方體”、“正四面體”或正八面體”),該種空隙的填充率為___________;若該晶胞密度為pgcm-3,硒化鋅的摩爾質量為Mgmol-1。用NA代表阿伏加德羅常數的數值,則晶胞參數a 為___________nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用98%的濃硫酸(密度為1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。現給出下列儀器(配制過程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL燒杯 ④托盤天平 ⑤100 mL容量瓶 ⑥膠頭滴管 ⑦玻璃棒,按使用儀器的先后順序排列正確的是 ( )
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下有①6.72LCH4 ②3.01×1023個HCl ③13.6gH2S ④0.2molNH3。下列對這四種氣體的關系從小到大表示不正確的是
A. 密度;①<④<③<②
B. 體積 ④<①<②<③
C. 質量 ④<①<③<②
D. 氫原子數 ②<④<③<①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關物質的轉化關系如圖所示(反應條件及部分產物已略去)。A、C、D中均含有相同的非金屬元素,C、G為氣體,D為淡黃色單質,I為常見強酸,反應③為化合反應。J溶液與KSCN溶液混合呈血紅色。A中僅含兩種元素,且元素質量比為7:8。

請回答下列問題:
(1)A的化學式為__________。
(2)H的電子式為__________。
(3)寫出①的離子方程式為__________。
(4)寫出②的化學方程式為____________并用單線橋標出電子轉移方向和數目。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組為測定放置已久的小蘇打樣品中純堿的質量分數,設計如下實驗方案:
(1)方案一:稱取一定質量的樣品,置于坩堝中加熱至恒重后,冷卻,稱取剩余固體質量,計算。
①完成本實驗需要不斷用玻璃棒攪拌,其目的是_______________________________。
②若實驗前所稱樣品的質量為m g,加熱至恒重時固體質量為a g,則樣品中純堿的質量分數為________。
(2)方案二:按如圖所示裝置進行實驗,并回答下列問題:
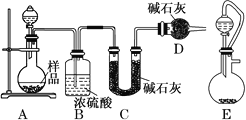
①實驗前先檢查裝置的氣密性,并稱取一定質量的樣品放入A中,將稀硫酸裝入分液漏斗中。D裝置的作用是________________。
②實驗中除稱量樣品質量外,還需分別稱量_______裝置反應前、后質量(填裝置字母代號)。
③根據此實驗得到的數據,測定結果有誤差。因為實驗裝置還存在一個明顯的缺陷,該缺陷是_________。
④有同學認為,用E裝置替代A裝置能提高實驗準確度。你認為是否正確?_________(填“是”或“否”)。
(3)方案三:稱取一定量的樣品置于錐形瓶中,加適量水,用鹽酸進行滴定,從開始至有氣體產生到氣體不再產生,所滴加的鹽酸體積如圖所示,則小蘇打樣品中純堿的質量分數為_________(保留兩位有效數字)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】流動電池可以在電池外部調節電解質溶液,從而維持電池內部電解質溶液濃度穩定,原理如圖。下列說法錯誤的是
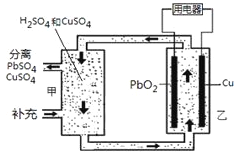
A.Cu為負極
B.PbO2電極的電極反應式為:PbO2+ 4H++ SO42-+ 2e-= PbSO4+ 2H2O
C.甲中應補充硫酸
D.當消耗1 mol PbO2,需分離出2 mol CuSO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋯(40Zr)是現代工業的重要金屬原料,具有良好的可塑性,抗蝕性能超過鈦。以鋯英石(主要成分是ZrSiO4,還含有少量A12O3、SiO2、Fe2O3等雜質)為原料生產鋯及其化合物的流程如圖所示:

(1)SiCl4的電子式為__________。上述流程中,高溫氣化存在多個反應,若不考慮反應中的損失,則分餾后得到的SiCl4質量通常比由純ZrSiO4發生的反應得到的SiCl4質量大,原因是___________________________________________________。
(2)高溫氣化后的固體殘渣除C外,還含有的金屬元素有________
(3)寫出上述流程中ZrCl4與水反應的化學方程式:_____________________。
(4)鋯還是核反應堆燃料棒的包裹材料,鋯合金在高溫下與水蒸氣反應產生氫氣,二氧化鋯可以制造耐高溫納米陶瓷。下列關于鋯、二氧化鋯的敘述中,正確的是_____(填序號)。
a.鋯合金比純鋯的熔點高,硬度小
b.二氧化鋯陶瓷屬于新型無機非金屬材料
c.將一束光線通過納米級二氧化鋯會產生一條光亮的通路
d.可采用氦作反應堆包裹核燃料的鋯合金的冷卻劑
(5)工業上電解K2ZrF6與KCl等組成的熔體也可制取金屬鋯。寫出電解的總反應方程式并標明
電子轉移的方向和數目 _________________________________________________。
(6)某燃料電池是以C2H4作為燃料氣,另一極通入氧氣,電解質是摻雜氧化釔(Y2O3)的氧化鋯(ZrO2)晶體,在熔融狀態下能傳導O2-,則負極上發生的反應式為_____________________。
(7)極稀溶液中溶質的物質的量濃度很小,常用其負對數pc表示(pcB=-lgcB)。如某溶液中溶質的物質的量濃度為1×10﹣5mol·L﹣1,則該溶液中溶質的pc=5。下列說法正確的是_____
A.電解質溶液的pc(H+)與pc(OH﹣)之和均為14
B.用鹽酸滴定某濃度的KOH溶液,滴定過程中pc(H+)逐漸增大
C.BaCl2溶液中逐滴加入硫酸溶液,滴加過程中pc(Ba2+)逐漸減小
D.某溫度下Ksp(Zr(CO3)2)=4.0×10﹣12,則其飽和溶液中pc(Zr4+)+ pc(CO32﹣)=7.7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以鉻酸鉀為原料,電化學法制備重鉻酸鉀的實驗裝置示意圖如下:下列說法不正確的是( )

A. 在陰極室,發生的電極反應為2H2O+2e-=2OH-+H2↑
B. 在陽極室,通電后溶液逐漸由黃色變為橙色,是因為陽極區H+濃度增大,使平衡2CrO+2H+![]() Cr2O+H2O向右移動
Cr2O+H2O向右移動
C. 該制備過程中總反應的化學方程式為4K2CrO4+4H2O=2K2Cr2O7+4KOH+2H2↑+O2↑
D. 測定陽極液中K和Cr的含量,若K與Cr的物質的量之比(nK/nCr)為d,則此時鉻酸鉀的轉化率為1-d
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com