
【題目】短周期元素W、X、Y、Z的原子序數依次遞增,a、b、c、d、e、f是由這些元素組成的化合物,d是淡黃色粉末,m為元素Y的單質,通常為無色無味的氣體。上述物質的轉化關系如圖所示。下列說法錯誤的是( )
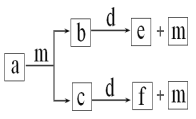
A.簡單離子半徑:Z<Y
B.簡單氣態氫化物的熱穩定性:Y>X
C.陰離子的還原性:Y>W
D.W2Y2中含有非極性鍵
【答案】C
【解析】
四種元素為短周期元素,且原子序數依次增大,d為淡黃色粉末,且d為化合物,推出d為Na2O2,能與Na2O2反應的物質為CO2、H2O,m為元素Y的單質,根據轉化關系,m為O2,b、c為H2O、CO2的一種,e、f分別對應NaOH、Na2CO3中的一種,即四種元素分別為H、C、O、Na,據此分析;
四種元素為短周期元素,且原子序數依次增大,d為淡黃色粉末,且d為化合物,推出d為Na2O2,能與Na2O2反應的物質為CO2、H2O,m為元素Y的單質,根據轉化關系,m為O2,b、c為H2O、CO2的一種,e、f分別對應NaOH、Na2CO3中的一種,即四種元素分別為H、C、O、Na,A、Z的簡單離子是Na+,Y的簡單離子是O2-,簡單離子半徑是r(O2-)>r(Na+),故A說法正確;
B、Y的簡單氫化物是H2O,X的簡單氫化物是CH4,O的非金屬性強于C,則H2O的熱穩定性強于CH4,故B說法正確;
C、Y的陰離子是O2-,W的陰離子是H-,還原性為H->O2-,故C說法錯誤;
D、W2Y2的化學式為H2O2,其結構式為H-O-O-H,含有極性鍵和非極性鍵,故D說法正確;
答案為C。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】用零價鐵(Fe)去除水體中的硝酸鹽(NO3-)已成為環境修復研究的熱點之一。
(1)Fe還原水體中NO3-的反應原理如圖所示。

①作負極的物質是________。
②正極的電極反應式是_________。
(2)將足量鐵粉投入水體中,經24小時測定NO3—的去除率和pH,結果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小時pH | 接近中性 | 接近中性 |
鐵的最終物質形態 |
|
|
pH=4.5時,NO3—的去除率低。其原因是________。
(3)實驗發現:在初始pH=4.5的水體中投入足量鐵粉的同時,補充一定量的Fe2+可以明顯提高NO3—的去除率。對Fe2+的作用提出兩種假設:
Ⅰ. Fe2+直接還原NO3—;
Ⅱ. Fe2+破壞FeO(OH)氧化層。
①做對比實驗,結果如右圖所示,可得到的結論是_______。
②同位素示蹤法證實Fe2+能與FeO(OH)反應生成Fe3O4。結合該反應的離子方程式,解釋加入Fe2+提高NO3—去除率的原因:______。

pH =4.5(其他條件相同)
(4)其他條件與(2)相同,經1小時測定NO3—的去除率和pH,結果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 約10% | 約3% |
1小時pH | 接近中性 | 接近中性 |
與(2)中數據對比,解釋(2)中初始pH不同時,NO3—去除率和鐵的最終物質形態不同的原因:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是![]()
A.![]() 溶液與
溶液與![]() 溶液混合后呈中性:
溶液混合后呈中性:![]()
B.![]()
![]() 溶液與過量NaOH溶液反應:
溶液與過量NaOH溶液反應:![]()
C.![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
D.![]() 溶液中加入過量的HI溶液:
溶液中加入過量的HI溶液:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴A是有機化學工業的基本原料,其產量可以用來衡量一個國家的石油化工發展水平,A還是一種植物生長調節劑,A可發生如圖所示的一系列化學反應。
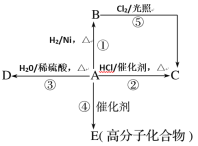
根據如圖回答下列問題:
(1)寫出B、D的結構簡式:B___;D___。
(2)寫出②⑤兩步反應的化學方程式,并注明反應類型:
②__(反應類型__)。
⑤__(反應類型__)。
(3)戊烷的同分異構體中,在相同條件下沸點最低的是__(寫結構簡式),其系統命名為:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴是一種重的化工原料,從淡化海水中提取溴的工藝流程如下:
![]()
⑴操作Ⅱ中,用飽和Na2CO3堿性溶液吸收Br2,過程中有CO2產生,反應的粒子方程式為______,當0.6 mol Br2被吸收時,轉移電子的數目為______
![]() 步驟Ⅳ包含萃取,分液和蒸餾,該過程中不必用到的儀器有______
步驟Ⅳ包含萃取,分液和蒸餾,該過程中不必用到的儀器有______![]() 填序號
填序號![]()
a.燒杯 b.分液漏斗c.普通漏斗 d.玻璃棒 e.蒸發皿 f.冷凝管
![]() 某化學興趣小組利用高錳酸鉀和濃鹽酸反應制取氯氣,并探究氯水的性質
某化學興趣小組利用高錳酸鉀和濃鹽酸反應制取氯氣,并探究氯水的性質
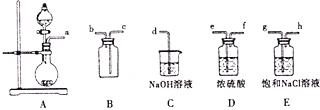
①將A,B,C相連,制得Cl2后加入適量水,即可制得氯水,將所得氯水分為兩份,進行甲,乙兩個實驗,實驗操作如下,將現象填入下表:
實驗序號 | 實驗操作 | 現象 |
甲 | 將氯水滴入品紅溶液 | ______ |
乙 | 氯水中加入碳酸氫鈉粉末 | 有無色氣泡產生 |
②由實驗乙不能推出氯氣與水反應的產物具有酸性,原因是______,若要制備純凈干燥的Cl2,按氣流方向連接各儀器接口,順序為a→_____→_____→_____→_____→_____→_____→d
![]() 實驗完畢后,假設裝置C中氫氧化鈉和
實驗完畢后,假設裝置C中氫氧化鈉和![]() 恰好完全反應,其反應方程式為______,反應后溶液中離子濃度由大到小的順序為______,常溫下HClO的電離平衡常數為K,則常溫下NaClO水解反應的平衡常數為______(用含Ka和Kw的表達式表示)
恰好完全反應,其反應方程式為______,反應后溶液中離子濃度由大到小的順序為______,常溫下HClO的電離平衡常數為K,則常溫下NaClO水解反應的平衡常數為______(用含Ka和Kw的表達式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有兩種有機物甲(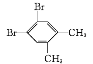 )和乙(
)和乙(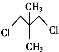 ),下列有關它們的說法中正確的是( )
),下列有關它們的說法中正確的是( )
A.二者的核磁共振氫譜中均只出現兩種峰且峰面積之比均為3∶2
B.二者在NaOH醇溶液中均可發生消去反應
C.一定條件下,乙在NaOH溶液中可發生取代反應,而甲不能發生此類反應
D.甲的一氯代物只有2種,乙的一溴代物有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列方程式書寫正確的是( )
A.HCO3-的電離方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.泡沫滅火器的原理:Al3++3HCO3-![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C.NH4Cl溶于H2O中:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
D.Na2S顯堿性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用![]() 表示阿伏加得羅常數,下列說法不正確的是
表示阿伏加得羅常數,下列說法不正確的是
A.對于![]() ,每當新形成
,每當新形成![]() 個
個![]() 鍵,需要斷開
鍵,需要斷開![]() 個
個![]() 鍵
鍵
B.![]() 熔融的
熔融的![]() 中含有的陽離子數為
中含有的陽離子數為![]()
C.次氯酸光照分解產生![]() 氣體
氣體![]() 標準狀況
標準狀況![]() 轉移的電子數為
轉移的電子數為![]()
D.電解精煉銅時,若陰極析出32g銅,則轉移的電子數為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com