
【題目】元素周期表是學習物質結構和性質的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R分別代表某一化學元素。請用所給元素回答下列問題。

(1)表中某元素原子的核外電子層數是最外層電子數的3倍,該元素的原子結構示意圖為_____________。R原子的最外層電子排布式____________________________;原子核外有________種能量不同的電子。R原子最外層有________種運動狀態不同的電子。
(2)元素Fe在元素周期表中的位置是__________________________________________。圖2中,55.85表示__________________________________________________________。
(3)表中某些元素的原子可形成與Ar具有相同電子層結構的簡單離子,這些離子的半徑由大到小的順序是____________________(填離子符號)。
(4)M、D兩種元素形成的化合物含有的化學鍵類型是____________________(填“極性鍵”或“非極性鍵”),其分子是____________________(填“極性分子”或“非極性分子”)。D、Q的最高價氧化物形成的晶體相比,熔點較高的是____________________(用化學式表示)。
(5)表中金屬性最強的元素與鋁元素相比較,可作為判斷金屬性強弱依據的是________(選填編號)。
a.能否置換出鋁鹽溶液中鋁
b.![]() 能否溶解在該元素最高價氧化物對應水化物中
能否溶解在該元素最高價氧化物對應水化物中
c.單質與氫氣化合的難易程度
d.單質與同濃度的稀鹽酸發生反應的劇烈程度
(6)在![]() 溶液中逐滴加入G的最高價氧化物的水化物,現象是先產生白色沉淀,然后白色沉淀逐漸消失。請用以上某化學方程式證明Al與G金屬性的強弱。______________________。O的非金屬性比N強,請用元素周期律的知識分析原因。___________________。
溶液中逐滴加入G的最高價氧化物的水化物,現象是先產生白色沉淀,然后白色沉淀逐漸消失。請用以上某化學方程式證明Al與G金屬性的強弱。______________________。O的非金屬性比N強,請用元素周期律的知識分析原因。___________________。
【答案】![]()
![]() 5 7 第四周期Ⅷ族 Fe元素的相對原子質量
5 7 第四周期Ⅷ族 Fe元素的相對原子質量 ![]() 極性鍵 非極性分子
極性鍵 非極性分子 ![]() bd
bd ![]() ,證明堿性
,證明堿性![]() O與N是同周期元素且O在N的右邊,同一周期從左到右,非金屬性逐漸增強,所以非金屬性O大于N
O與N是同周期元素且O在N的右邊,同一周期從左到右,非金屬性逐漸增強,所以非金屬性O大于N
【解析】
根據元素在周期表中的位置分析可知,A為H元素,D為C元素,E為O元素,G為Na元素,Q為Si元素,M為S元素,R為Cl元素,結合元素周期律與物質的結構與性質的關系分析作答。
(1)根據可知,某元素原子的核外電子層數是最外層電子數的3倍,則該元素為Na,其原子結構示意圖為![]() ;R為Cl元素,原子序數為17,其最外層電子排布式為:
;R為Cl元素,原子序數為17,其最外層電子排布式為:![]() ;電子排布式為:1s22s22p63s23p5,不同的能級所具有的能量不同,故原子核外有5種能量不同的電子;每個電子的運動狀態均不相同,因此Cl原子最外層有7種不同運動狀態的電子;
;電子排布式為:1s22s22p63s23p5,不同的能級所具有的能量不同,故原子核外有5種能量不同的電子;每個電子的運動狀態均不相同,因此Cl原子最外層有7種不同運動狀態的電子;
(2)元素Fe的原子序數為26,在元素周期表中的位置為第四周期Ⅷ族,55.85表示Fe元素的相對原子質量;
(3)Ar的原子結構示意圖為:![]() ,則上述元素中,與Ar具有相同電子層結構的微粒為S2-和Cl-,因同周期中,具有相同電子層結構的簡單粒子核電荷數越小,其半徑越大,故兩者的大小順序為:
,則上述元素中,與Ar具有相同電子層結構的微粒為S2-和Cl-,因同周期中,具有相同電子層結構的簡單粒子核電荷數越小,其半徑越大,故兩者的大小順序為:![]() ;
;
(4)M、D分別是S和C,兩者形成的化合物為CS2,由2對碳硫雙鍵形成的直線型結構,是由極性鍵組成的非極性分子;D、Q的最高價氧化物形成的晶體分別是CO2和SiO2,因CO2分子晶體,而SiO2為原子晶體,則熔點較高的是SiO2;
(5)表中金屬性最強的元素為Na,與Al相比:
a. Na在鹽溶液中首先與水反應,不會置換出鋁,不能作為判斷依據,a項錯誤;
b. ![]() 能否溶解在NaOH中,說明NaOH為強堿,可作為判斷依據,b項正確;
能否溶解在NaOH中,說明NaOH為強堿,可作為判斷依據,b項正確;
c. 單質與氫氣化合的難易程度,是判斷非金屬性強弱的依據,c項錯誤;
d. 單質與同濃度的稀鹽酸發生反應的劇烈程度,體現了金屬的活動性強弱,即金屬性強弱,d項正確;
故答案為:bd;
(6)先產生白色沉淀,然后白色沉淀逐漸消失,說明NaOH溶解了![]() ,其化學方程式為:
,其化學方程式為:![]() ,故堿性比較:NaOH>
,故堿性比較:NaOH>![]() ,即金屬性:Na>Al;O與N是同周期元素且O在N的右邊,同一周期從左到右,非金屬性逐漸增強,所以非金屬性O大于N,故答案為:
,即金屬性:Na>Al;O與N是同周期元素且O在N的右邊,同一周期從左到右,非金屬性逐漸增強,所以非金屬性O大于N,故答案為:![]() ,證明堿性
,證明堿性![]() ;O與N是同周期元素且O在N的右邊,同一周期從左到右,非金屬性逐漸增強,所以非金屬性O大于N。
;O與N是同周期元素且O在N的右邊,同一周期從左到右,非金屬性逐漸增強,所以非金屬性O大于N。


科目:高中化學 來源: 題型:
【題目】對于反應A(g)+4B(g)![]() 2C(g)+2D(g),下列數據表示反應進行得最快的是( )
2C(g)+2D(g),下列數據表示反應進行得最快的是( )
A.v(A)=1.4mol/(Ls)B.v(B)=3.6 mol/(Ls)
C.v(C)=2mol/(Ls)D.v(D)=30 mol/(Lmin)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醇與氫鹵酸反應是制備鹵代烴的重要方法。實驗室制備溴乙烷和1-溴丁烷的反應如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反應有:醇在濃硫酸的存在下脫水生成烯和醚,Br-被濃硫酸氧化為Br2等。有關數據見下表:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g.cm3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸點/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
請回答下列問題:
(1)溴乙烷和1溴丁烷的制備實驗中,下列儀器最不可能用到的是________(填字母)。
a.圓底燒瓶 b.量筒 c.錐形瓶 d.布氏漏斗
(2)溴代烴的水溶性________(填“大于”、“等于”或“小于”)相應的醇,其原因是______________________________________________________________。
(3)將1溴丁烷粗產品置于分液漏斗中加水,振蕩后靜置,產物在________(填“上層”“下層”或“不分層”)。
(4)制備操作中,加入的濃硫酸必須進行稀釋,其目的是________(填字母)。
a.減少副產物烯和醚的生成 b.減少Br2的生成
c.減少HBr的揮發 d.水是反應的催化劑
(5)欲除去溴乙烷中的少量雜質Br2,下列物質中最適合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制備溴乙烷時,采用邊反應邊蒸出產物的方法,其有利于___________________,但在制備1溴丁烷時卻不能邊反應邊蒸出產物,其原因是___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一容積可變的密閉容器中加入WO3和H2進行反應:WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列說法不正確的是( )
W(s)+3H2O(g),下列說法不正確的是( )
A.將容器的體積縮小一半,其反應速率增大
B.保持體積不變,充入氬氣,其反應速率不變
C.保持壓強不變,充入氖氣,H2O(g)的生成速率增大
D.保持壓強不變,充入氖氣,H2O(g)、H2(g)的生成速率減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知斷裂1 mol共價鍵所需要吸收的能量分別為H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列對H2(g)+I2(g)![]() 2HI(g)的反應類型判斷錯誤的是( )
2HI(g)的反應類型判斷錯誤的是( )
A.放出能量的反應B.吸收能量的反應
C.氧化還原反應D.可逆反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以乙炔為原料通過以下流程能合成有機物中間體D。

已知:(1)
(2):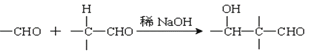
請回答下列問題:
(1)化合物A的分子式為___________,1mol A完全燃燒需要消耗_____mol氧氣。
(2)反應②的反應類型是:______________;化合物B的名稱是:____________。
(3)寫出①反應的化學方程式_________________________________________________。
(4)已知1mol HCHO和1mol CH3CH2CHO發生類似已知(2)的反應,生成1molE。寫出E的結構簡式為:_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖甲和圖乙表示的是元素的某種性質隨原子序數的變化。下列說法正確的是
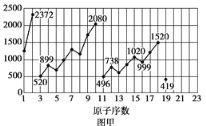
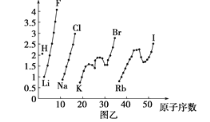
A. 圖乙不可能表示元素的電負性隨原子序數的變化關系
B. 圖甲可能表示的是元素單質的熔點隨原子序數的變化關系
C. 圖乙可能表示的是元素原子的半徑隨原子序數的變化關系
D. 圖甲可能表示的是元素原子的第一電離能隨原子序數的變化關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酸牛奶中的乳酸可增進食欲、促進胃液分泌、增強腸胃的消化功能,對人體具有保健作用,乳酸分子的結構簡式為![]() 。工業上可由乙烯來合成乳酸,方法如下:
。工業上可由乙烯來合成乳酸,方法如下:
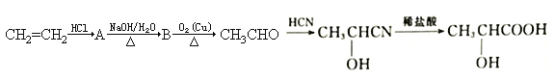
(1)乳酸所含的官能團的名稱是_________________________。
(2)寫出下列物質轉化的化學方程式:
①A→B______________________________________。
②B→CH3CHO____________________________________。
(3)A在一定條件下可發生消去反應,寫出其發生消去反應的化學方程式:____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學反應與能量變化的說法正確的是

A. 如圖所示的化學反應中,反應物的鍵能之和大于生成物的鍵能之和
B. 相同條件下,氫氣和氧氣反應生成液態水比生成等量的氣態水放出的熱量少
C. 金剛石在一定條件下轉化成石墨能量變化如圖所示,熱反應方程式可為:C(s金剛石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同溫同壓下,H2(g)+C12(g)==2HCl(g)能量變化如圖所示,在光照和點燃條件下的△H相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com