
【題目】請按要求填空:
(1)C、N元素形成的新材料具有如圖所示的結構該晶體的化學式為________________。
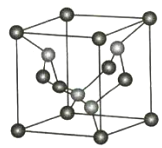
![]() C(位于頂點和面心)
C(位于頂點和面心)![]() N
N
(2)氮化碳和氮化硅晶體結構相似,是新型的非金屬高溫陶瓷材料,它們的硬度大、熔點高、化學性質穩定。
①氮化硅的硬度________(填“大于”或“小于”)氮化碳的硬度,原因是___________________________。
②已知氮化硅的晶體結構中,原子間都以單鍵相連,且氮原子與氮原子不直接相連、硅原子與硅原子不直接相連,同時每個原子都滿足最外層8電子穩定結構,請寫出氮化硅的化學式:______________。
(3)第ⅢA、VA元素組成的化合物GaN、GaP、CaAs等是人工合成的新型半導體材料,其晶體結構與晶體硅相似。在GaN晶體中,每個Ga原子與________個N原子相連,與同一個Ga原子相連的N原子構成的空間構型為________。在四大晶體類型中,GaN屬于________晶體。
【答案】C3N4 小于 硅原子半徑大于碳原子半徑,氮碳形成的共價鍵鍵長比氮硅形成的共價鍵鍵長短,故氮碳形成的共價鍵的鍵能大 Si3N4 4 正四面體形 原子
【解析】
(1)根據晶胞結構計算化學式,角上原子計![]() ,棱上原子計
,棱上原子計![]() ,面上原子計
,面上原子計![]() ,內部原子計1;
,內部原子計1;
(2)①原子晶體鍵長越短,鍵能越大,晶體硬度越大;②根據最外層8電子穩定結構,寫出氮化硅的化學式;
(3)GaN晶體與晶體硅結構相似,為原子晶體,空間構型為正四面體結構。
(1)根據晶胞的結構可知含有碳原子數目![]() ,氮原子數目為4,則化學式為:C3N4,故答案為:C3N4;
,氮原子數目為4,則化學式為:C3N4,故答案為:C3N4;
(2)①氮化碳和氮化硅晶體結構相似,是新型的非金屬高溫陶瓷材料,它們的硬度大、熔點高、化學性質穩定,這說明二者形成的晶體都是原子晶體,由于硅原子半徑大于碳原子半徑,氮碳形成的共價鍵鍵長比氮硅形成的共價鍵鍵長短,鍵能大,所以氮化硅的硬度小于氮化碳的硬度,故答案為:小于;硅原子半徑大于碳原子半徑,氮碳形成的共價鍵鍵長比氮硅形成的共價鍵鍵長短,故氮碳形成的共價鍵的鍵能大;
②N的最外層電子數為5,要滿足8電子穩定結構,需要形成3個共價鍵,Si的最外層電子數為4,要滿足8電子穩定結構,需要形成4個共價鍵,所以氮化硅的化學式為:Si3N4,故答案為:Si3N4;
(3)GaN的晶體結構與晶體硅相似,則GaN屬于原子晶體,每個Ga原子與4個N原子相連,與同一個Ga原子相連的N原子構成的空間構型為正四面體形,故答案為:4;正四面體形;原子。


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E五種元素,其中A、B、C屬于同一周期,A元素原子最外層p能級的電子數等于次外層的電子總數,C元素原子最外層中有2個未成對電子。已知C、D、E元素原子核內的質子數均與中子數相等,且C元素可分別與A、B、D、E生成![]() 型化合物,在
型化合物,在![]() 中,D與C的質量比為7:8,在
中,D與C的質量比為7:8,在![]() 中,E與C的質量比為1:1。
中,E與C的質量比為1:1。
請回答下列問題:
(1)寫出A、E兩種元素的元素符號:A ____________ 、E ____________ 。
(2)寫出D元素原子的核外電子排布式: ____________ 。
(3)指出E在元素周期表中的位置: ____________ 。
(4)比較A、B、C三種元素的第一電離能的大小: ____________ (填元素符號,下同)。
(5)比較D元素和E元素的電負性的相對大小: ____________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.熔融狀態下硫酸氫鉀中的離子鍵、共價鍵均被破壞,形成定向移動的離子,因而能夠導電
B.F2、Cl2、Br2、I2的熔沸點逐漸升高,是因為分子間作用力越來越大
C.NH3和Cl2兩種分子中,每個原子的最外層都達到8電子的穩定結構
D.HF、HCl、HBr、HI的穩定性逐漸減弱,沸點逐漸升高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖所示轉化關系中A、B、C均為雙原子氣態單質,分別由短周期主族元素X、Y、Z組成。其中單質B含共用電子對數最多,甲和丙分子中均含有10個電子。下列說法錯誤的是( )
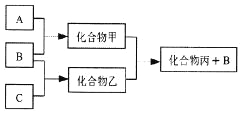
A. Z元素位于第二周期第VIA族
B. 可用排水法收集化合物乙
C. 元素X、Y、Z的原子半徑大小關系為X<Z<Y
D. 化合物甲溶于化合物丙中,存在的微粒有5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、Q為原子序數依次增大的前四周期元素,X的核外有2個未成對電子,與題述其他元素均能形成二元化合物;Y是地殼中含量最多的金屬元素;Z的第一電離能比同周期相鄰兩種元素的都大;W的外層電子數是最內層電子數的9倍;Q的某種核素的質量數為56,中子數為30。據此回答下列問題:
(1)Q的基態原子的價電子排布式為______________。
(2)題述元素中,電負性最大的是______________(填元素符號),第一電離能介于Y和Z之間的同周期元素有______________(填元素符號)。
(3)Y和W的氯化物中熔點較高的是________(填化學式),原因是_____;與Z的低價氯化物互為等電子體的離子是_______(填一種即可)。
(4)咖啡因對中樞神經有興奮作用,其結構簡式如圖所示。常溫下,咖啡因在水中的溶解度很小,加適量水楊酸鈉[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是_________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學和生活、社會發展息息相關,從古代文物的修復到現在的人工智能,我們時時刻刻能感受到化學的魅力。下列說法不正確的是
A. 銀器發黑重新變亮涉及了化學變化
銀器發黑重新變亮涉及了化學變化
B. 煤綜合利用時采用了干餾和液化等化學方法
煤綜合利用時采用了干餾和液化等化學方法
C. 瓷器主要成分屬于硅酸鹽
瓷器主要成分屬于硅酸鹽
D. 芯片制造中的“光刻技術”是利用光敏樹脂在曝光條件下成像,該過程并不涉及化學變化
芯片制造中的“光刻技術”是利用光敏樹脂在曝光條件下成像,該過程并不涉及化學變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水四氯化錫(SnC14)是一種用途廣泛的化工中間體,常用作媒染劑和有機合成的氯化催化劑。熔融的金屬錫(熔點231℃)在300℃左右能直接與Cl2作用生成無水四氯化錫,實驗室裝置如圖所示:

已知信息如下:①將金屬錫熔融,通人干燥氯氣進行反應,生成四氯化錫。②無水四氯化錫是無色易流動的液體,熔點為一33℃,沸點為114.1℃。二氯化錫是無色晶體,熔點為246℃,沸點為652℃。③無水四氯化錫在空氣中極易水解,水解產物之一是SnO2.xH2O,并產生白煙。請回答下列問題:
(l)開始實驗前一定要____,E中冷水的作用是 ___。
(2)裝置F中盛放的最佳試劑為 ___,作用是____。
(3)實驗時應先打開A處分液漏斗旋塞和整套裝置的閥門,待觀察到____這一現象時,再點燃D處酒精燈。
(4)若撤去裝置C,則D中還可能發生反應的化學方程式為 __。
(5) Cl2和錫作用即可生成SnC14,也會生成SnCl2,為減少SnCl2的生成,可采取的措施是 _______ .
(6)得到的產物中常含有雜質SnCl2,SnCl2是常用的還原劑。某實驗小組用碘氧化法滴定分析產品中雜質SnCl2的質量分數。準確稱取a克該樣品于錐形瓶,用適量濃鹽酸溶解,淀粉溶液作指示劑,c mol.L-l碘標準溶液滴定至終點,消耗標準液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,則產品中雜質SnCl2的質量分數為____(用含a、c的代數式表示);即使此法測定的操作均正確,但測得的SnCl2含量仍低于實際含量,其原因可能是________(用離子方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“點擊化學”是指快速、高效連接分子的一類反應,例如銅催化的Huisgen環加成反應:

我國科研人員利用該反應設計、合成了具有特殊結構的聚合物F并研究其水解反應。合成線路如下圖所示:
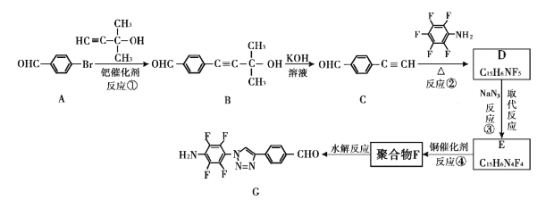
已知:![]()
(1)A生成B的反應類型是____。
(2)關于B和C,下列說法正確的是____(填字母序號)。
a 利用核磁共振氫譜可以鑒別B和C b B不能發生消去反應 c 可用酸性高錳酸鉀溶液檢驗C中含醛基
(3)B生成C的過程中還有另一種生成物X,分子式為C3H6O,核磁共振氫譜顯示只有一組峰,X的結構簡式為 ___。
(4)反應②的化學方程式為 ___。
(5)請根據以上流程,并推測聚合物F所具有的特殊結構,下列關于聚合物F的結構說法正確的是___
A F中必含 -CH2=N- 結構
B F中必含 -N=N- 結構
C F的結構可能是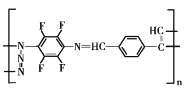
(6)H是比A多一個碳原子的同系物。H的同分異構體中符合下列條件的有 ___種。
①苯環上有三個取代基 ②能和FeCl3發生顯色反應
(7)為了探究連接基團對聚合反應的影響,設計了單體K,其合成路線如下,寫出H、I、J的結構簡式:___
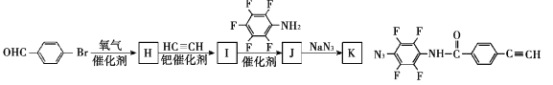
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】L多巴胺是一種有機物,它可用于帕金森綜合癥的治療,其結構簡式如下
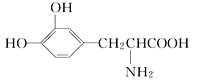
下列關于L多巴胺的敘述不正確的是( )
A. 它屬于α氨基酸,既具有酸性,又具有堿性
B. 它遇到FeCl3溶液顯紫色
C. 它可以兩分子間縮合形成分子式為C18H18O6N2的化合物,該化合物中有3個六元環
D. 它既與酸反應又與堿反應,等物質的量的L多巴胺最多消耗NaOH與HCl的物質的量之比為1∶1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com