
【題目】根據雜化軌道理論和價電子對互斥理論模型判斷,下列分子或離子的中心原子雜化方式及空間構型正確的是( )
選項 | 分子或離子 | 中心原子雜化方式 | 價電子對互斥理論模型 | 分子或離子的空間構型 |
A | H2O | sp1 | 直線形 | 直線形 |
B | BBr3 | sp2 | 平面三角形 | 三角錐形 |
C | PCl3 | sp2 | 四面體形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
【答案】D
【解析】
A.H2O中心原子O原子的價層電子對數=2+![]() =4,雜化方式為sp3,價層電子對互斥模型為四面體形,分子的立體構型為V型結構,故A錯誤;
=4,雜化方式為sp3,價層電子對互斥模型為四面體形,分子的立體構型為V型結構,故A錯誤;
B.BBr3分子中心原子B原子的價層電子對數=3+![]() =3,雜化方式為sp2,價層電子對互斥模型為平面三角形,分子的立體構型為平面三角形,故B錯誤;
=3,雜化方式為sp2,價層電子對互斥模型為平面三角形,分子的立體構型為平面三角形,故B錯誤;
C.PCl3分子中心原子P原子的價層電子對數=3+![]() =4,雜化方式為sp3,價層電子對互斥模型為四面體形,分子的立體構型為三角錐形,故C錯誤;
=4,雜化方式為sp3,價層電子對互斥模型為四面體形,分子的立體構型為三角錐形,故C錯誤;
D.CO32-分子中心原子C原子的價層電子對數=3+![]() =3,雜化方式為sp2,價層電子對互斥模型為平面三角形,分子的立體構型為平面三角形,故D正確;
=3,雜化方式為sp2,價層電子對互斥模型為平面三角形,分子的立體構型為平面三角形,故D正確;
故選D。


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案科目:高中化學 來源: 題型:
【題目】某溫度下,向一定體積0.1mol·L-1的氨水中逐滴加入等濃度的鹽酸,溶液中pOH [pOH=-lg c(OH-)]與pH的變化關系如圖所示。下列說法不正確的是
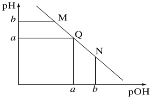
A.M點和N點溶液中H2O的電離程度相同
B.Q點溶液中,c(H+)=c(OH-),pH =7
C.M點溶液的導電性小于Q點溶液的導電性
D.N點溶液加水稀釋,![]() 變小
變小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列化學反應中,既有離子鍵、極性鍵、非極性鍵斷裂,又有離子鍵、極性鍵、非極性鍵形成的是
A.2Na2O+2H2O=4NaOH
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 都是非極性分子,
都是非極性分子,![]() 都是極性分子,由此推測ABn型分子是非極性分子的經驗規律是( )
都是極性分子,由此推測ABn型分子是非極性分子的經驗規律是( )
A.所有原子在同一平面上B.分子中每個鍵的鍵長應相等
C.A的相對原子質量小于BD.在ABn中A原子沒有孤電子對
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知O、S、Se、Te、Po、Lv是同主族元素,其原子序數依次增大。回答下列問題:
(1)Lv在周期表中的位置是_________。
(2)下列有關性質的比較,能用元素周期律解釋的是_________。
a.離子半徑:Te2->Se2- b.熱穩定性:H2O>H2S
c.熔、沸點:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)從原子結構角度解釋Se與S的最高價氧化物對應的水化物酸性不同的原因_________。
(4)實驗室用如下方法制備H2S并進行性質驗證。
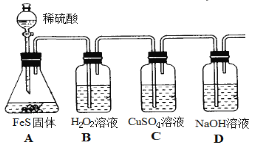
①設計B裝置的目的是證明_________,B中實驗現象為_______________。
②實驗中經檢測發現C中溶液pH降低且出現黑色沉淀。C中反應的離子方程式是_______________。
③有同學根據“強酸制弱酸”原理認為裝置A、C中兩個反應相矛盾,認為C中不可能出現上述現象。該觀點不正確的理由是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在20 L的密閉容器中按物質的量之比1∶2充入CO和H2,發生反應CO(g)+2H2(g)CH3OH(g) ΔH。測得CO的轉化率隨溫度的變化及不同壓強下CO的變化如圖所示,p2和195 ℃時n(H2)隨時間的變化結果如下表所示。下列說法正確的是( )
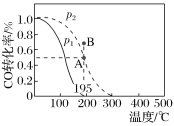
p2和195 ℃時n(H2)
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195 ℃時,0~3 min,反應速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.p1<p2,ΔH>0
C.195 ℃、p2時,在B點:v正>v逆
D.在p2和195 ℃時,該反應的平衡常數為25
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E五種短周期元素,它們的原子序數依次增大。已知A和C、B和D分別位于同主族,且B、D質子數之和是A、C質子數之和的2倍;![]() 在同周期元素中原子半徑最小。
在同周期元素中原子半徑最小。
(1)B形成的雙原子分子中,共價鍵的類型有__,化合物A2B中B原子采取__雜化。
(2)A2B和A2D的沸點較高者是__(填化學式),其原因是_。
(3)E原子的電子排布式為__。
(4)寫出均由A、B、C、D四種元素組成的兩物質的濃溶液發生反應的離子方程式:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向20.00 mL 0.1 mol·L-1 NaOH溶液中滴加0.1 mol·L-1苯甲酸(C6H5COOH,弱酸)溶液,溶液的pH和pOH[pOH=-lgc(OH-)]關系如圖所示。
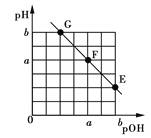
下列說法正確的是
A.在該溫度下,0.1 mol·L-1 NaOH溶液的pH=2a+1
B.F點對應苯甲酸溶液體積V=20.00 mL
C.在G與F之間某點對應的溶液中水的電離程度最大
D.溫度不變,加水稀釋E點溶液,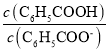 增大
增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①![]() ;
;
②苯環上的取代基對新導入的取代基進入苯環的位置有顯著的影響。如圖表示以苯為原料制備一系列有機物的轉化過程:
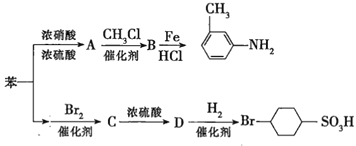
(1)![]() 是一種密度比水___________(填“大”或“小”)的無色液體,苯轉化為
是一種密度比水___________(填“大”或“小”)的無色液體,苯轉化為![]() 的化學方程式是______。
的化學方程式是______。
(2)在“苯![]() ”的轉化過程中,屬于取代反應的是______(填序號,下同),屬于加成反應的是_________。
”的轉化過程中,屬于取代反應的是______(填序號,下同),屬于加成反應的是_________。
(3)有機物![]() 苯環上的二氯代物有__________種結構;
苯環上的二氯代物有__________種結構;![]() 的所有原子____(填“在”或“不在”)同一平面上。
的所有原子____(填“在”或“不在”)同一平面上。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com