
【題目】已知FeCl3溶液與KI溶液的反應為可逆反應,某小組同學對該反應進行實驗探究。
(1)甲同學首先進行了實驗1。
實驗 1 | 實驗步驟 | 實驗現象 |
ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴約為0.05 mL,下同)。 | ⅰ. 溶液呈棕黃色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不顯紅色。 |
① 寫出FeCl3溶液與KI溶液反應的離子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同學認為溶液不顯紅色的原因是反應體系中c(Fe3+)太低,改進實驗方案,進行實驗2。
實驗2 | 實驗步驟 | 實驗現象 |
ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黃色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液顯紅色。 | |
ⅲ. 繼續加入2 mL CCl4,充分振蕩、靜置。 | ⅲ. 液體分層,上層紅色消失,變為棕黃色,下層呈紫紅色。 |
本實驗改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化學平衡原理解釋實驗2中加入CCl4后上層溶液紅色消失的原因________________。
(2)甲同學認為“用CCl4萃取后上層溶液仍為棕黃色”的原因是I2未被充分萃取,但乙同學查閱資料得到信息:I2、I3-在水中均呈棕黃色,兩者有如下關系:I2+I-![]() I3-。于是提出假設:萃取后的溶液呈棕黃色的主要原因是存在I3-。
I3-。于是提出假設:萃取后的溶液呈棕黃色的主要原因是存在I3-。
① 為驗證假設,乙同學設計并完成了實驗3。
實驗3 | 實驗步驟 | 實驗現象 |
ⅰ. 取1 mL實驗2中棕黃色的上層清液,再加入2 mL CCl4, 振蕩、靜置。 | ⅰ. 液體分層,上層呈黃色,下層呈紫紅色。 | |
ⅱ. 取1 mL飽和碘水,加入2 mL CCl4, 振蕩、靜置。 | ⅱ. 液體分層,上層為無色,下層呈紫紅色。 |
實驗3的結論是_________________________________。
② 甲同學依據乙同學的實驗設計思路,選用實驗2中的試劑,運用控制變量的方法設計了更加嚴謹的實驗,證明了平衡I2+I-![]() I3-的存在。
I3-的存在。
請你補充完整他設計的實驗步驟:將實驗2中下層紫紅色溶液平均分成兩份,分裝于兩支試管中,向試管1中加入1 mL水,振蕩、靜置;向試管2中_________________。兩支試管中的現象分別為__________________________________。
【答案】2Fe3++2I- ![]() 2Fe2++I2 檢驗溶液中是否大量存在Fe3+ 提高平衡時溶液中的c(Fe3+) 加入CCl4后,I2被CCl4萃取,平衡2Fe3++2I—
2Fe2++I2 檢驗溶液中是否大量存在Fe3+ 提高平衡時溶液中的c(Fe3+) 加入CCl4后,I2被CCl4萃取,平衡2Fe3++2I—![]() 2Fe2++I2正向移動,或c(Fe3+)降低,平衡Fe3++3SCN—
2Fe2++I2正向移動,或c(Fe3+)降低,平衡Fe3++3SCN—![]() Fe(SCN)3逆向移動,或c[Fe(SCN)3]降低,所以紅色消失 萃取后的溶液呈棕黃色的主要原因是存在I3- 加入1 mL 0.1 mol·L-1 KI溶液,振蕩、靜置 試管1中液體分層,上層為無色,下層呈紫紅色,試管2中液體分層,上層呈黃色,下層呈紫紅色(或紫紅色變淺)
Fe(SCN)3逆向移動,或c[Fe(SCN)3]降低,所以紅色消失 萃取后的溶液呈棕黃色的主要原因是存在I3- 加入1 mL 0.1 mol·L-1 KI溶液,振蕩、靜置 試管1中液體分層,上層為無色,下層呈紫紅色,試管2中液體分層,上層呈黃色,下層呈紫紅色(或紫紅色變淺)
【解析】
試題(1)①根據FeCl3溶液與KI溶液的反應為可逆反應,化學方程式為 2FeCl3+2KI2KCl+2FeCl2+I2,離子方程式是2Fe3+ +2I-2Fe2+ +I2;②檢驗Fe3+常用的試劑是KSCN溶液,向溶液中滴入KSCN溶液,Fe3++3SCN-Fe(SCN)3,溶液變為血紅色。所以,此處加入KSCN溶液的目的是檢驗溶液中是否大量存在Fe3+;③FeCl3溶液與KI溶液的反應為可逆反應,c(I-)降低,平衡向左移動,c(Fe3+)增大,進而驗證甲同學的想法;在溶液中存在兩個平衡:平衡1:2Fe3++ 2I- 2Fe2++I2, 平衡2:Fe3++ 3SCN- Fe(SCN)3,加入CCl4后,I2被CCl4萃取,c(I2)減小,平衡1向右移動,c(Fe3+)減小,平衡2向左移動,c[Fe(SCN)3]降低,紅色消失;
(2)①由實驗3可知,再向1 mL實驗2中棕黃色的溶液中加2 mL CCl4,上層黃色溶質仍不能被萃取,同樣的向1 mL飽和碘水中加入2 mL CCl4,卻能夠將碘水萃取為無色,證明萃取后的溶液呈棕黃色的主要原因是存在I3-,而不是I2;②要證明平衡I2+I-![]() I3-的存在,需把試管1作為參照,向試管2提供與實驗2完全相同的KI溶液,所以加入的是1 mL0.1 mol·L-1KI溶液,試管1中液體分層,上層為無色,下層呈紫紅色,試管2中液體分層,上層呈黃色,即生成了I3-,下層呈紫紅色(或紫紅色變淺)。
I3-的存在,需把試管1作為參照,向試管2提供與實驗2完全相同的KI溶液,所以加入的是1 mL0.1 mol·L-1KI溶液,試管1中液體分層,上層為無色,下層呈紫紅色,試管2中液體分層,上層呈黃色,即生成了I3-,下層呈紫紅色(或紫紅色變淺)。


科目:高中化學 來源: 題型:
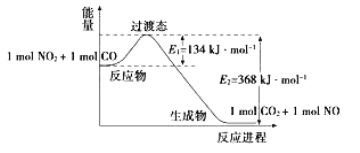
【題目】(1)如圖是NO2和CO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式:_______________________________________________________。
(2)總反應:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O寫出下列的電極反應式
負極:_____________________________
正極:_____________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原電池產生電流的本質原因是( )
A. 電解質溶液中有電離出的自由移動的離子
B. 有導線將兩個活潑性不同的電極連接
C. 在不同金屬的兩極間存在電勢差
D. 在原電池中發生了氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】萜類化合物廣泛存在于動植物體內,關于下列萜類化合物的說法正確的是
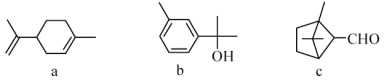
A. a和b都屬于芳香族化合物
B. b的一氯代物有5種
C. a、b和c均能和氫氣在一定條件下發生加成反應
D. a和c分子中所有碳原子均處于同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A. 煤礦內瓦斯、煤氣、油田氣中都含有甲烷
B. 農村沼氣池產生的可燃氣體是甲烷
C. 煤礦坑氣是植物殘體經微生物發酵而產生
D. 甲烷是天然氣的主要成分
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知液氨能和NaH反應放出H2:NaH + NH3 =NaNH2 + H2↑,它也能和Na反應放出H2。據此下列說法中錯誤的是( )
A. 液氨和NaH反應中,液氨是氧化劑
B. 液氨和NaH反應生成的H2既是氧化產物又是還原產物
C. 液氨和Na反應產物中有NaNH2
D. 液氨和NaH或Na反應都屬于置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳族元素包括碳、硅、鍺(Ge)、錫(Sn)、鉛等,它們的單質及化合物廣泛應用于我們生活的各個領域。鍺和錫以前曾被用于半導體材料,鉛被用來制造蓄電池。碳族元素在化合物中只有鉛以低價形式存在時較穩定,其它元素在化合物中都是以高價形式存在比較穩定,回答下列問題:
I.(1)高嶺土的成分中含Al2(Si2O5)(OH)4,請改寫成氧化物的形式_________________.
(2)實驗室用單質錫粉制取少量二氯化錫溶液,制取和保存的方法是(用文字敘述)_______________________________
(3)鉛有多種氧化物,寫出四氧化三鉛與濃鹽酸反應的離子方程式_____________________ .二氧化鉛在空氣中強熱會得到一系列鉛的其它氧化物。若把239g二氧化鉛強熱,當質量變為231g時,寫出反應的化學方程式____________________________.
II.CH4–CO2催化重整不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
CH4–CO2催化重整反應為:CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)= CH4 (g) ΔH=–75 kJ·mol1 ①
C(s)+O2(g)=CO2(g) ΔH=–394 kJ·mol1 ②
2C(s)+O2 (g)=2CO(g) ΔH=–222kJ·mol1 ③
(1)有利于提高CH4平衡轉化率的條件是____(填標號)。
A.高溫低壓 B.低溫高壓 C.高溫高壓 D.低溫低壓
(2)若該反應在容積不變的絕熱容器中進行,能夠判斷該反應已達到平衡的是____(填標號)。
A.c(CO2)/c(H2)不再發生變化
B.氣體的密度不再發生變化
C.氣體的平均摩爾質量不再發生變化
D.每有8molC-H鍵生成的同時有4molH-H鍵的斷裂 E.容器的溫度不再發生變化
(3)T℃時,在體積為10 L的容器中加入10 mol CH4、5 mol CO2以及催化劑進行重整反應,達到平衡時CO2的轉化率是50%,此溫度下,該反應的化學平衡常數K=_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷化硼是一種超硬耐磨涂層材料,右圖為其晶胞,其中的每個原子均滿足8電子穩定結構。下列有關說法正確的是( )

A. 磷化硼晶體的熔點很低
B. 磷化硼晶體的化學式為BP,屬于離子晶體
C. 磷化硼晶體中每個原子均形成4條共價鍵
D. 磷化硼晶體結構中微粒的空間堆積方式與氯化鈉相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com