
【題目】為探究銅與稀硝酸反應的產物及影響反應速率的主要因素,進行如下實驗。
實驗一 探究銅與稀硝酸反應的產物實驗裝置如圖所示,氣密性已檢查。

已知:FeSO4+NO===[Fe(NO)]SO4,該反應較緩慢,待生成一定量[Fe(NO)]2+時突顯明顯
棕色。
(1)實驗開始時先將Y形試管向盛有碳酸鈣的支管傾斜,緩慢滴入稀硝酸,該實驗操作的目的是___________________________________________________________。
(2)銅片和稀硝酸反應的化學方程式為____________________________________。
(3)本實驗A生成的氣體中,若有NO2,則B的實驗現象為__________________;
若只有NO生成,則B的實驗現象是_________________。
實驗二 探究化學反應產物對反應速率的影響
設計如下實驗,利用上圖裝置測定溶液突顯明顯棕色的時間。
序號 | 溫度 | 銅片/(g) | 硝酸/mL | 硝酸銅/g |
1 | 25 ℃ | ① | ② | ③ |
2 | 25 ℃ | 5 | 20 | 0.5 |
3 | 25 ℃ | 5 | 20 | 1.0 |
(4)請將上表中實驗1的實驗條件填寫完整。
①________,②________,③________。
(5)通過實驗發現實驗1、2、3的反應速率并無明顯變化,為達到實驗目的還需要繼續進行的實驗是_______________________________________________________。
【答案】 利用生成的CO2將整個裝置內的空氣趕盡,避免NO和O2反應生成NO2對氣體產物的觀察產生干擾 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O B瓶溶液出現血紅色 B瓶溶液出現棕色 5 20 0 研究NO對反應速率的影響
【解析】本題分析:本題主要考查對于“探究銅與稀硝酸反應的產物及影響反應速率的主要因素”實驗的評價。
(1)實驗開始時先將Y形試管向盛有碳酸鈣的支管傾斜,緩慢滴入稀硝酸,該實驗操作的目的是利用生成的CO2將整個裝置內的空氣趕盡,避免NO和O2反應生成NO2對氣體產物的觀察產生干擾 。
(2)銅片和稀硝酸反應的化學方程式為3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
(3)本實驗A生成的氣體中,若有NO2,則B的實驗現象為B瓶溶液出現血紅色;若只有NO生成,則B的實驗現象是B瓶溶液出現棕色。
(4)請將上表中實驗1的實驗條件填寫完整。
①5,②20,③0。
(5)通過實驗發現實驗1、2、3的反應速率并無明顯變化,為達到實驗目的還需要繼續進行的實驗是研究NO對反應速率的影響。


 金鑰匙試卷系列答案
金鑰匙試卷系列答案科目:高中化學 來源: 題型:
【題目】氯元素的單質及其化合物在生產生活中應用極其廣泛。請完成下列填空:
Ⅰ:氯氣性質探究
設計下圖實驗裝置來制備并驗證氯氣的性質(部分夾持裝置未畫出)。
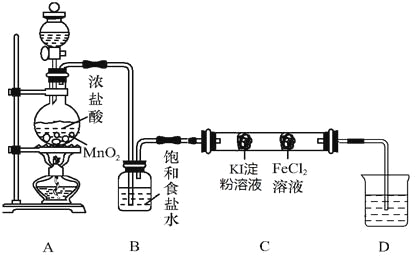
(1)A中放置固體二氧化錳的裝置名稱是___________________。
(2)裝置B的作用是___________________。
(3)硬質玻璃管C中事先裝有兩個沾有相關試劑的棉球,左側棉球的實驗現象為 。
(4)D中的NaOH溶液用來吸收尾氣,向反應后的D中加入足量稀硫酸會產生氣體,寫出該反應的離子方程式 。
Ⅱ:制備HClO
(5)設計裝置E代替上圖的裝置C,用于制備較高濃度的HClO溶液。在圓底燒瓶底部,有一用塑料網包住的過量塊狀碳酸鈣。
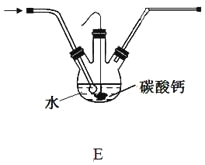
①該方案可以制得較高濃度HClO的原因是(結合必要的化學語言回答) 。
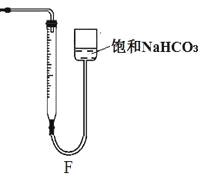
②反應結束后將塑料網中剩余的石灰石提出液面,所得的溶液與稀鹽酸混合,立即產生大量CO2氣體,則反應所得溶液中的溶質除HClO外,還含有 、 (寫兩種鈣鹽的化學式,一種正鹽,一種酸式鹽);該小組同學測得反應中碳酸鈣質量減少M g,反應后從所得的200mL溶液中取用10mL與足量稀鹽酸混合,連接F裝置測得產生的氣體體積為V L(已換算成標準狀況),則原溶液中含鈣正鹽的濃度為 mol·L-1(用含M、V的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于石油的說法正確的是 ( )
A.液化石油氣、天然氣都是可再生能源B.石油主要含有碳、氫兩種元素
C.石油的裂化和裂解都屬于物理變化D.石油分餾出的各餾分均是純凈物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數,下列說法正確的是( )
A. 含0.1 mol Na2O2的晶體中陽離子與陰離子總數為0.4NA
B. 46 g NO2和N2O4的混合氣體中含有的氧原子數為2NA
C. 1 mol Fe與一定量硝酸恰好完全反應時,轉移電子數一定為3NA
D. 1 mol CH4與過量氯氣發生取代反應,生成CH3Cl氣體的體積約為22.4 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有一包氯化鉀樣品中含有少量碳酸鉀、硫酸鉀和不溶于水的雜質。為了提純氯化鉀,先將樣品溶于適量水中,充分攪拌后過濾,再將濾液按下圖所示步驟進行操作。

回答下列問題:
(1)試劑I的化學式為_______,加入試劑I后,①對應的實驗操作是______,①中發生反應的離子方程式為________。
(2)檢驗濾液中的 是否有SO42-的方法是______________________________________。
(3)試劑Ⅱ的化學式為_______,②中加入試劑Ⅱ的目的是__________。
(4)試劑Ⅲ的名稱是________,③中發生反應的離子方程式為_________。
(5)某同學稱取提純的產品0.745g,溶解后定容在100mL容量瓶中,取25.00mL溶液,與0.1000 mol·L![]() 的硝酸銀標準溶液反應,反應消耗硝酸銀標準溶液的體積為23.50 mL,該產品的純度為_________________。
的硝酸銀標準溶液反應,反應消耗硝酸銀標準溶液的體積為23.50 mL,該產品的純度為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列一系列反應,最終產物為草酸(乙二酸)。
A![]() B
B![]() C
C![]() D
D![]() E
E![]()
![]()
已知A為某一溴代物。
請回答下列問題:
(1)推測下列化合物的結構簡式:
B________________________,E________________________。
(2)D 分子中的官能團名稱是_______________________。
(3)寫出下列轉化過程的化學方程式:
A→B________________________;反應類型:_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在金屬活動順序表中錫(Sn)位于Fe與Cu之間.
(1)為了測定金屬錫樣品的純度(假定雜質不參加反應),實驗步驟如下:將ag金屬錫樣品溶于鹽酸中.向上述溶液中加入過量的FeCl3溶液(發生的反應為:Sn2++2Fe3+=Sn4++2Fe2+).用bmol/L的K2Cr2O7溶液滴定生成的Fe2+,共用去K2Cr2O7溶液mmL.
請回答:
①用鹽酸溶解金屬時發生反應的離子方程式________。
②已知酸性環境下,Cr2O72-可被Fe2+還原為Cr3+,則Ⅲ中反應的離子方程式是:
_________________。
③樣品中錫的質量分數是________________(Sn的摩爾質量為Mg/mol,用含a、b、m、M的代數式表示)。
(2)興趣小組同學用如圖所示裝置在實驗室中制取無水SnCl4.已知SnCl4易水解

①按氣流方向各接口的正確連接順序是a_____________________gf。
②干燥管的作用是______________________________________。
③NaOH溶液中發生反應的離子方程式___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com