
【題目】氯化亞砜(SOCl2)是一種液態化合物,在農藥、制藥行業中用途廣泛。實驗室合成原理為:SO2+Cl2+SCl2=2SOCl2,部分裝置如圖所示,回答以下問題:

已知:①SOCl2沸點為78.8℃,SCl2 的沸點為50℃,且兩種液體可互溶。
②SOCl2遇水劇烈反應,液面上產生白霧,并帶有刺激性氣味的有氣體產生。
(1)實驗室制取SOCl2在三頸燒瓶中進行,整個裝置所選儀器的連接順序是:⑥→__________→①,②←______________(某些儀器可以多次使用)。
(2)儀器a的名稱是________,儀器b的作用是____________。
(3)本實驗中制Cl2的離子方程式為___________________,本實驗中制SO2的化學方程式為______________________,SOCl2與水反應的化學方程式為___________。
(4)實驗結束后,從三頸燒瓶分離出SOCl2的實驗操作名稱是_________________。若反應中消耗Cl2的體積為896 mL(標準狀況,SO2足量),最后得到純凈的SOCl2 7.14 g,則SOCl2的產率為_________________。
【答案】→→⑨→⑩ ⑩←⑨←⑦ 球形冷凝管 吸收逸出的Cl2、SO2,防止空氣中的水蒸氣進入反應裝置而使SOCl2水解 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O SOCl2+H2O=SO2↑+2HCl↑ 蒸餾 75%
Mn2++Cl2↑+2H2O Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O SOCl2+H2O=SO2↑+2HCl↑ 蒸餾 75%
【解析】
實驗室用二氧化錳與濃鹽酸制取氯氣:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,制備的氯氣中混有HCl和水蒸氣,用飽和食鹽水吸收HCl,用濃硫酸干燥氯氣,二氧化硫氣體由亞硫酸鈉和濃硫酸制備,同理用濃硫酸干燥制得的二氧化硫氣體,干燥純凈的氯氣和二氧化硫在三頸燒瓶中反應制得SOCl2,SO2+Cl2+SCl2=2SOCl2,SOCl2易水解,氯氣和二氧化硫污染空氣,不能直接排放,故冷凝管上連接的盛有堿石灰的干燥管,實驗結束后,將三頸燒瓶中混合物蒸餾得到產品,據此分析作答。
Mn2++Cl2↑+2H2O,制備的氯氣中混有HCl和水蒸氣,用飽和食鹽水吸收HCl,用濃硫酸干燥氯氣,二氧化硫氣體由亞硫酸鈉和濃硫酸制備,同理用濃硫酸干燥制得的二氧化硫氣體,干燥純凈的氯氣和二氧化硫在三頸燒瓶中反應制得SOCl2,SO2+Cl2+SCl2=2SOCl2,SOCl2易水解,氯氣和二氧化硫污染空氣,不能直接排放,故冷凝管上連接的盛有堿石灰的干燥管,實驗結束后,將三頸燒瓶中混合物蒸餾得到產品,據此分析作答。
(1)二氧化錳與濃鹽酸制備氯氣,固液加熱型,故為⑥,飽和食鹽水吸收HCl,用濃硫酸干燥氯氣,二氧化硫氣體由亞硫酸鈉和濃硫酸制備,用⑦,同理用濃硫酸干燥制得的二氧化硫氣體,干燥純凈的氯氣和二氧化硫在三頸燒瓶中反應制得SOCl2,除雜干燥為充分,導氣管應長進短出,則連接順序為:⑥→→→⑨→⑩→①,②←⑩←⑨←⑦;
(2)儀器a的名稱是球形冷凝管,儀器b的作用是吸收逸出的Cl2、SO2,防止空氣中的水蒸氣進入反應裝置而使SOCl2水解;
(3)實驗室用二氧化錳與濃鹽酸制備氯氣,離子反應為:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;本實驗中制SO2的化學方程式為:Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O;根據題意SOCl2與水反應產生白霧,并帶有刺激性氣味的氣體產生,說明生成HCl和二氧化硫,故反應為:SOCl2+H2O=SO2↑+2HCl↑;
Mn2++Cl2↑+2H2O;本實驗中制SO2的化學方程式為:Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O;根據題意SOCl2與水反應產生白霧,并帶有刺激性氣味的氣體產生,說明生成HCl和二氧化硫,故反應為:SOCl2+H2O=SO2↑+2HCl↑;
(4)已知氯化亞砜沸點為78.8℃,SCl2的沸點為50℃,所以采用分餾的方法即可將之分離;消耗氯氣為0.896L/22.4L·mol-1=0.04mol,由SO2+Cl2+SCl2=2SOCl2,生成0.08molSOCl2,則SOCl2的產率為7.14g/(0.08mol×119g·mol-1)×100%=75%。


科目:高中化學 來源: 題型:
【題目】某化學小組想制取CuO并證明CuO能加快KClO3的分解速率,設計并進行如下實驗:
(一)制取CuO
①稱取2 g膽礬研細后放入燒杯,加適量蒸餾水溶解;
②向步驟①所得溶液中逐滴加入NaOH溶液至銅離子沉淀完全;
③將步驟②所得沉淀過濾、洗滌,灼燒至恒重,研細備用。
回答下列問題:
(1)上述實驗步驟中溶解、過濾時玻璃棒的作用依次是_____________。
(2)步驟③中灼燒前后,沉淀顏色的變化為_______。
(3)利用化學方法證明銅離子已經沉淀完全的操作是____________。
(二)證明CuO能加快KClO3的分解速率,并與MnO2的催化效率進行比較
用下圖裝置進行實驗,且均以生成相同狀況下20 mL氧氣為準,其它可能影響實驗的因素均已忽略,相關數據見下表:

實驗序號 | KClO3質量 | 其它物質質量 | 待測數據 |
① | 1.5 g | 無其他物質 | |
② | 1.5 g | CuO 0.5 g | |
③ | 1.5 g | MnO2 0.5 g |
(4)上述實驗中的待測數據指_____________;該實驗除以上思路外,還可以通過測定______________來比較CuO和MnO2的催化效率。
(5)本實驗裝置圖中量氣裝置由乳膠管和儀器A_______________(填名稱)及50 mL___________(填“酸式”或“堿式”)滴定管改造后組裝而成;
(6)為探究CuO在實驗②中是否起催化作用,需補做如下實驗:
a.CuO的質量有沒有改變;
b.CuO的化學性質有沒有改變。
簡述驗證CuO質量是否改變的操作過程_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式如圖所示,下列關于該有機物的性質說法錯誤的是( )
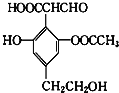
A. 1mol該物質可與4mol氫氧化鈉溶液反應
B. 與NaHCO3溶液反應可以產生CO2氣體
C. 該物質與H2反應,1mol該物質最多消耗3mol H2
D. 該物質可以使酸性KMnO4溶液褪色,也可發生消去反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在新制飽和氯水中,若只改變某一條件,下列敘述正確的是
A. 再通入少量氯氣,![]() 減小
減小
B. 通入少量SO2,溶液漂白性增強
C. 加入少量的碳酸氫鈉粉末,pH增大,溶液漂白性增強
D. 光照過程中,有氣泡冒出,溶液的導電性減弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】幾種短周期元素的原子半徑及主要化合價如表:
元素代號 | X | Y | Z | W |
原子半徑 | 160 | 143 | 70 | 66 |
主要化合價 |
|
|
|
|
下列敘述正確的是
A. X的電負性大于Y的電負性
B. W的氫化物比同族其它元素的氫化物穩定,是因為W的氫化物中存在氫鍵
C. Y的最高價氧化物對應的水化物能溶于稀硫酸和稀氨水
D. W的非金屬性比Y強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅元素在化合物中其化合價可以呈現![]() 、
、![]() 價。
價。![]() 和
和![]() 是常見的
是常見的![]() 價銅的化合物,
價銅的化合物,![]() 是較為常見的
是較為常見的![]() 價銅的化合物。
價銅的化合物。
(1)銅元素位于周期表的_______區。
A、s B、p C、d D、ds E、f
(2)向![]() 溶液中滴加氨水,可以得到深藍色的溶液,再加入乙醇后析出深藍色晶體,寫出深藍色晶體的化學式__________________。比較
溶液中滴加氨水,可以得到深藍色的溶液,再加入乙醇后析出深藍色晶體,寫出深藍色晶體的化學式__________________。比較![]() 和
和![]() 中
中![]() 鍵角的大小:
鍵角的大小:![]() ___________
___________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)![]() 中陰離子的空間構型為_______,NO3-中的大π鍵應表示為______
中陰離子的空間構型為_______,NO3-中的大π鍵應表示為______
[信息:臭氧分子中,中心氧原子的未雜化的p軌道(含2個電子)與其它兩個氧原子的p軌道(各含1個電子)肩并肩形成一個大π鍵,表示為![]() ,]
,]
![]() 的晶胞結構如圖所示,C1原子位于立方體的頂點和面心,Cu原子位于Cl原子構成的四面體體心。
的晶胞結構如圖所示,C1原子位于立方體的頂點和面心,Cu原子位于Cl原子構成的四面體體心。
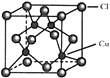
①每個Cl原子周圍距Cl原子最近且等距離的Cu原子數目為________________。
②若以銅原子為頂點構成晶胞,面心原子為________(Cu、Cl)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】往含0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持續穩定地通入CO2氣體,當通入氣體的體積為6.72 L(標準狀況下)時立即停止,則在這一過程中,溶液中離子的物質的量和通入CO2氣體的體積關系正確的圖像是(氣體的溶解忽略不計)( )
A.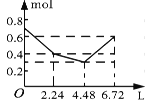 B.
B. C.
C.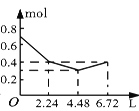 D.
D.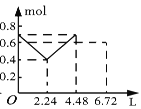
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在容積為1L的密閉容器中充入![]() 和
和![]() 發生
發生![]() 測得
測得![]() 的物質的量隨時間的變化如圖所示,(已知,此溫度下,該反應的平衡常數
的物質的量隨時間的變化如圖所示,(已知,此溫度下,該反應的平衡常數![]() )下列說法正確的是 ( )
)下列說法正確的是 ( )
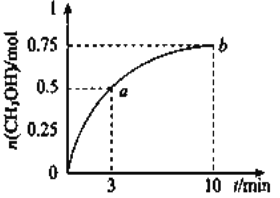
A. ![]()
B. 點b所對應的狀態為化學平衡狀態
C. ![]() 的生成速率,點a低于點b
的生成速率,點a低于點b
D. 欲增大平衡狀態時![]() ,可保持其他條件不變,升高溫度
,可保持其他條件不變,升高溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項所示的物質間轉化均能實現的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com