
【題目】現有下列反應:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O
針對上述兩個反應回答:
(1)用單線橋標出①中電子轉移的方向和數目_____;
(2)寫出②的離子化學方程式____;
(3)Cl2、SO2和KMnO4的氧化性由強到弱的順序為____;
(4)反應②中氯化氫表現出的性質是____。
a.還原性 b.酸性 c.氧化性
【答案】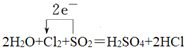 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O KMnO4 >Cl2>SO2 ab
2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O KMnO4 >Cl2>SO2 ab
【解析】
(1)2H2O+Cl2+SO2=H2SO4+2HCl中Cl元素由0價降低為-1價,共得到2個電子,S元素由+4價升高為+6價,共失去2個電子,據此分析解答;
(2)2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O中KMnO4、HCl、KCl、MnCl2 可以拆成離子形式,據此書寫離子方程式;
(3)氧化還原反應中,氧化劑的氧化性強于氧化產物的氧化性,氧化劑的氧化性強于還原劑的氧化性,據此分析判斷;
(4)在參加反應的鹽酸中,有部分鹽酸的化合價變化,部分不變,據此分析判斷。
(1)2H2O+Cl2+SO2=H2SO4+2HCl中Cl元素由0價降低為-1價,共得到2個電子,S元素由+4價升高為+6價,共失去2個電子,電子轉移的方向和數目用單線橋表示為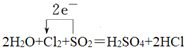 ,故答案為:
,故答案為: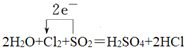 ;
;
(2)2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O 的離子方程式為2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故答案為:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)氧化還原反應中,氧化劑的氧化性強于還原劑的氧化性,根據反應①得氧化性是:Cl2>SO2;氧化還原反應中,氧化劑的氧化性強于氧化產物的氧化性,根據反應②得出氧化性是:KMnO4>Cl2,所以氧化性:KMnO4>Cl2>SO2,故答案為:KMnO4>Cl2>SO2;
(4)反應②2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O中氯化氫生成氯氣表現還原性,生成氯化鉀、氯化錳表現酸性,故答案為:ab。


 金鑰匙試卷系列答案
金鑰匙試卷系列答案科目:高中化學 來源: 題型:
【題目】(1)在質量分數為28%的KOH水溶液中,OH-與H2O數目之比是________。
(2)由硫酸鉀、硫酸鐵和硫酸組成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO42-)=0.6 mol/L,則c(K+)為________。
(3)相同物質的量濃度的氯化鈉、氯化鎂、氯化鋁溶液,分別與硝酸銀溶液反應,當生成沉淀的質量之比為3∶2∶1時,消耗三種鹽溶液的體積比為________。
(4)A物質按下式分解:2A=B↑+ 2C↑ + 2D↑,測得生成的混合氣體在相同條件下的密度是O2密度的m倍,則A的摩爾質量為______________。
(5)某狀況下a L氨氣(此時氣體摩爾體積為Vm)溶解在一定量的水中形成b mL氨水溶液,所得溶液的密度為ρ g/mL,則該氨水的物質的量濃度可表示為________mol/L;氨水的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知化學反應①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化學平衡常數為K1;化學反應②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化學平衡常數為K1;化學反應②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化學平衡常數為K2,在溫度973 K和1173 K的情況下,K1、K2的值分別如下:
FeO(s)+H2(g),其化學平衡常數為K2,在溫度973 K和1173 K的情況下,K1、K2的值分別如下:
溫度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通過表格中的數值可以推斷:反應①是_______(填“吸熱”或“放熱”)反應。
(2)現有反應③:CO2(g)+H2(g)![]() CO(g)+H2O(g),請你寫出該反應的平衡常數K3的表達式:K3=______。
CO(g)+H2O(g),請你寫出該反應的平衡常數K3的表達式:K3=______。
(3)根據反應①與②可推導出K1、K2與K3之間的關系式為__________,據此關系式及上表數據,能推斷出反應③是________(填“吸熱”或“放熱”)反應。
(4)要使反應③在一定條件下建立的平衡向正反應方向移動,可采取的措施有______ 、_____ (填寫字母序號)。
A.縮小反應容器的容積 B.擴大反應容器的容積
C.升高溫度 D.使用合適的催化劑
E.設法減小平衡體系中的CO的濃度
(5)圖甲、乙分別表示反應③在t1時刻達到平衡,在t2時刻因改變某個條件而發生變化的情況:

①圖甲中t2時刻發生改變的條件是__________。
②圖乙中t2時刻發生改變的條件是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)等質量的CO和SO2分別裝入同溫同體積的容器,所含氧原子之比___,壓強之比___。
(2)在標準狀況下,由CO和CO2組成的混合氣體8.96L,質量是16g。此混合物中CO和CO2的物質的量之比是___,混合氣體的平均摩爾質量是___。
(3)將標準狀況下aL的HCl(g)溶于1000g水,得到的鹽酸的密度為bg/cm3,則該鹽酸的物質的量濃度為___mol·L-1。
(4)1.204╳1023個NH4+的物質的量為__mol,質量為____g.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置或操作正確的是( )
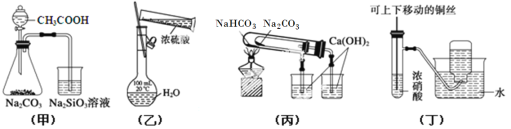
A. 用甲圖裝置驗證CH3COOH、H2CO3和H2SiO3的酸性強弱
B. 用乙圖裝置配制一定濃度的稀硫酸
C. 用丙圖裝置驗證NaHCO3和Na2CO3的熱穩定性
D. 用丁圖裝置制備并收集少量NO2氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在相應的條件下可能大量共存的是( )
A. 能使pH試紙變紅的溶液中:CO32-、K+、Cl-、Na+
B. 由水電離產生的c(OH-)=1×10-10mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在![]() =1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
=1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
D. ![]() =10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣通入NaOH溶液中會發生反應:Cl2+2NaOH=NaCl+NaClO+H2O,該反應的氧化產物是
A.Cl2B.NaOHC.NaClD.NaClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.油脂的皂化反應得到高級脂肪酸鹽和甘油
B.纖維素和淀粉互為同分異構體
C.氨基酸之間能發生反應,合成更復雜的多肽,構成蛋白質
D.紫外線的殺菌作用主要原因是蛋白質的變性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com