
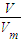 計算2.24 L NH3的物質(zhì)的量,每個NH3含有3個N-H,計算N-H的物質(zhì)的量,再根據(jù)N=nNA計算共價鍵數(shù)目;
計算2.24 L NH3的物質(zhì)的量,每個NH3含有3個N-H,計算N-H的物質(zhì)的量,再根據(jù)N=nNA計算共價鍵數(shù)目;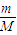 計算7.8 g Na2O2的物質(zhì)的量,過氧化鈉與水反應2Na2O2+2H2O=2NaOH+O2,反應中過氧化鈉起氧化劑與還原劑作用,各占
計算7.8 g Na2O2的物質(zhì)的量,過氧化鈉與水反應2Na2O2+2H2O=2NaOH+O2,反應中過氧化鈉起氧化劑與還原劑作用,各占 ,起還原劑作用的過氧化鈉中氧元素化合價由-1價升高為0價,據(jù)此計算轉(zhuǎn)移電子物質(zhì)的量,再根據(jù)N=nNA計算轉(zhuǎn)移電子數(shù)目.
,起還原劑作用的過氧化鈉中氧元素化合價由-1價升高為0價,據(jù)此計算轉(zhuǎn)移電子物質(zhì)的量,再根據(jù)N=nNA計算轉(zhuǎn)移電子數(shù)目.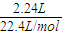 =0.1mol,每個NH3含有3個N-H,故N-H的物質(zhì)的量為0.1mol×3=0.3mol,共價鍵數(shù)目為0.3mol×6.02×1023mol-1=1.806×1023,故A錯誤;
=0.1mol,每個NH3含有3個N-H,故N-H的物質(zhì)的量為0.1mol×3=0.3mol,共價鍵數(shù)目為0.3mol×6.02×1023mol-1=1.806×1023,故A錯誤;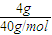 =0.1mol,溶于水配成1L溶液,所得溶液的濃度為0.1mol/L,100g蒸餾水的體積為0.1L,溶液的體積不是1L,故C錯誤;
=0.1mol,溶于水配成1L溶液,所得溶液的濃度為0.1mol/L,100g蒸餾水的體積為0.1L,溶液的體積不是1L,故C錯誤;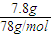 =0.1mol,過氧化鈉與水反應2Na2O2+2H2O=2NaOH+O2,反應中過氧化鈉起氧化劑與還原劑作用,各占
=0.1mol,過氧化鈉與水反應2Na2O2+2H2O=2NaOH+O2,反應中過氧化鈉起氧化劑與還原劑作用,各占 ,起還原劑作用的過氧化鈉中氧元素化合價由-1價升高為0價,轉(zhuǎn)移電子物質(zhì)的量為0.1mol×
,起還原劑作用的過氧化鈉中氧元素化合價由-1價升高為0價,轉(zhuǎn)移電子物質(zhì)的量為0.1mol× ×2×1=0.1mol,故轉(zhuǎn)移電子數(shù)目為0.1mol×6.02×1023mol-1=6.02×1022,故D正確;
×2×1=0.1mol,故轉(zhuǎn)移電子數(shù)目為0.1mol×6.02×1023mol-1=6.02×1022,故D正確;

國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com