
【題目】現有五種元素,其中A、B、C為短周期主族元素,D、E為第四周期元素,它們的原子序數依次增大。請根據下列相關信息回答問題:
A元素原子的核外電子數和電子層數相等
B元素原子的核外p電子數比s電子數少1
C元素的第一至第四電離能如下:![]()
![]()
![]()
![]()
D是前四周期中金屬性最強的元素
E在周期表的第七列
(1)已知BA5為離子化合物,寫出其電子式:__________。
(2)B元素基態原子中能量最高的電子,其電子云在空間有___個伸展方向,原子軌道呈 _____ 形。
(3)某同學根據上述信息,推斷C元素基態原子的軌道表示式為 ,該同學所畫的軌道表示式違背了 __________________ 。
,該同學所畫的軌道表示式違背了 __________________ 。
(4)E位于第 _________ 族、 _____ 區,該元素原子的核外電子排布式為 _______。
(5)檢驗D元素的方法是 _____ ,請用原子結構的知識解釋產生此現象的原因:__________。
【答案】 3 啞鈴 泡利不相容原理 ⅦB d
3 啞鈴 泡利不相容原理 ⅦB d ![]() 焰色反應 當基態原子的電子吸收能量后,電子會躍遷到較高能級,變成激發態原子,電子從較高能量的激發態躍遷回基態時,將以光的形式輻射能量
焰色反應 當基態原子的電子吸收能量后,電子會躍遷到較高能級,變成激發態原子,電子從較高能量的激發態躍遷回基態時,將以光的形式輻射能量
【解析】
A元素原子的核外電子數與電子層數相等,則A只能是氫元素;B元素原子的核外p電子數比s電子數少1,則只能是![]() ,即氮元素;C的第三電離能顯著增大,因此C位于第
,即氮元素;C的第三電離能顯著增大,因此C位于第![]() 族,前四周期中金屬性最強的元素為鉀,即D為鉀元素,則C只能為鎂元素,E位于第
族,前四周期中金屬性最強的元素為鉀,即D為鉀元素,則C只能為鎂元素,E位于第![]() 族,即錳元素,據此來分析本題即可。
族,即錳元素,據此來分析本題即可。
(1)離子化合物NH5為氫化銨,其電子式為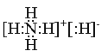 ;
;
(2)N原子的基態原子中能量最高的電子為p電子,p電子云在空間有3個伸展方向,原子軌道呈啞鈴形;
(3)題圖中3s軌道的兩個電子自旋方向相同,違背了泡利不相容原理;
(4)E元素位于周期表中第四周期第ⅦB族,屬于d區元素,原子核外電子排布式為![]() ;
;
(5)檢驗鉀元素常用焰色反應,當基態原子的電子吸收能量后,電子會躍遷到較高能級,變成激發態原子,電子從較高能量的激發態躍遷回基態時,將以光的形式輻射出能量。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】“綠水青山就是金山銀山”。目前人們對環境保護、新能源開發很重視,研究NO2、NO、CO、SO2等大氣污染物轉化為能參與大氣循環的物質,對建設美麗中國具有重要意義。
(1)有人設計通過硫循環完成CO的綜合處理,原理為
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
則CO和水蒸氣完全反應生成H2和CO2的熱化學方程式為__________________________________。
(2)CO可在一定條件下轉化為CH3OH。已知:向2L密閉容器中通入2 molCO和4molH2,在適合的催化劑和T1溫度下,發生反應CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min時達到平衡狀態,10min后改變溫度為T2,20min時達到平衡狀態,反應過程中部分數據見表:
CH3OH(g) △H<0,10min時達到平衡狀態,10min后改變溫度為T2,20min時達到平衡狀態,反應過程中部分數據見表:
反應時間 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min內的平均反應速率v(CO)= _______;在20min時,溫度T2下,該反應的化學平衡常數為________________。
②若30min時升高溫度,化學平衡常數值_______(填:“增大“減小”“不變”)。
③在T1溫度下,既能增大反應速率和提高CO平衡轉化率的措施有_____________(填兩種措施即可)
④在恒溫恒容下,下列可以判斷CO(g)+2H2(g)![]() CH3OH(g)反應達到平衡狀態的________(填序號)。
CH3OH(g)反應達到平衡狀態的________(填序號)。
a.2v正(H2)=v逆(CH3OH) b.混合氣體的物質的量不再變化
c.單位時間內有1 mol CO消耗同時消耗2molH2 d.混合氣體的平均相對分子質量不變
(3)已知反應2NO(g)+O2(g)![]() 2NO2的正反應速率v正=k1Cm(NO)Cn(O2),其中k1為速率常數,可通過下表實驗數據計算k1、m、n。
2NO2的正反應速率v正=k1Cm(NO)Cn(O2),其中k1為速率常數,可通過下表實驗數據計算k1、m、n。
組別 | 起始濃度/mol·L-1 | 初始速率/ mol·L-1·S-1 | |
NO | O2 | ||
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0.0125 | 31.92×10-3 |
則k1=____, m =_____, n =_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是
A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)減小
B. 將CH3COONa溶液從20 ℃升溫至30 ℃,溶液中c(CH3COO-)/c(CH3COOH)c(OH-)增大
C. 向鹽酸中加入氨水至中性,溶液中![]() >1
>1
D. 常溫下,pH=2的醋酸溶液與pH=12的NaOH溶液等體積混合后,溶液pH<7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素X、Y、Z和W在周期表中的位置如圖所示,原子序數之和為48。下列說法不正確的是( )
X | Y | |
Z | W |
A.原子半徑大小比較:r(X)>r(Y)
B.X和W可形成共價化合物XW3
C.W的非金屬性比Z的弱
D.Z的最低價單核陰離子的失電子能力比Y的強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、磷、砷(As)、銻(Sb)、鉍(Bi)、鏌(Mc)為元素周期表中原子序數依次增大的同族元素。回答下列問題:
(1)砷在元素周期表中的位置 _________ ![]() 的中子數為______________________。
的中子數為______________________。
(2)熱穩定性:NH3______________________PH3(填“>”或“<”)。
(3)PH3和NH3與鹵化氫的反應相似,產物的結構和性質也相似。下列對PH3與HI反應產物的推斷正確的是 ____________(填序號)。
a.不能與NaOH反應 b.含離子鍵、共價鍵 c.能與水反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是
A.用排飽和食鹽水法收集Cl2
B.加壓有利于合成氨反應
C.冰鎮的啤酒打開后泛起泡沫
D.對2HI![]() H2+I2(g)平衡體系增加壓強使顏色變深
H2+I2(g)平衡體系增加壓強使顏色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下述實驗中均有紅棕色氣體產生,對比分析所得結論正確的是( )
① | ② | ③ |
|
|
|
A.由①中的紅棕色氣體,可推知反應還有氧氣產生
B.紅棕色氣體表明②中木炭與濃硝酸發生了反應
C.由③可說明濃硝酸具有揮發性和強氧化性
D.③的氣體產物中檢測出CO2,由此說明木炭一定與濃硝酸發生了反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明N2O與CO在Fe+作用下發生反應的能量變化及反應歷程如下圖所示,下列說法錯誤的是

A. 反應總過程ΔH<0
B. Fe+使反應的活化能減小
C. FeO+也是該反應的催化劑
D. Fe++N2O![]() FeO++N2、FeO++CO
FeO++N2、FeO++CO![]() Fe++CO2兩步反應均為放熱反應
Fe++CO2兩步反應均為放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】部分等電子體類型、代表物質及對應的空間構型如表所示:
等電子類型 | 代表物質 | 空間構型 |
四原子24電子等電子體 | SO3 | 平面三角形 |
四原子26電子等電子體 | SO32- | 三角錐形 |
五原子32電子等電子體 | CCl4 | 四面體形 |
六原子40電子等電子體 | PCl5 | 三角雙錐形 |
七原子48電子等電子體 | SF6 | 八面體形 |
請回答下列問題。
(1)請寫出下列離子的空間構型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子構成,與F2互為等電子體的離子是__________。
(3)![]() 的空間構型如圖1所示,請再按照圖1的表示方法在圖2中表示出
的空間構型如圖1所示,請再按照圖1的表示方法在圖2中表示出![]() 分子中O、S、F原子的空間位置。已知
分子中O、S、F原子的空間位置。已知![]() 分子中O、S間為共價雙鍵,S、F間為共價單鍵。__________。
分子中O、S間為共價雙鍵,S、F間為共價單鍵。__________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com