
【題目】在不同溫度下,水溶液中![]() 與
與![]() 關系如圖所示。下列說法不正確的是
關系如圖所示。下列說法不正確的是![]()
![]()
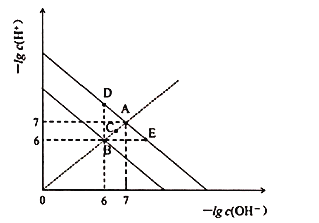
A.圖中五點![]() 間的關系:
間的關系:![]()
B.![]() 點對應的水溶液中,可能有
點對應的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同時存在
大量同時存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 與
與![]() 關系如圖D點所示,則溶液中有:
關系如圖D點所示,則溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,當
溶液,當![]() 與
與![]() 關系如圖E點所示,則溶液中反應:
關系如圖E點所示,則溶液中反應:![]()
【答案】C
【解析】
由圖象可知,A、E、D都為![]() 時的曲線上,水的Kw只與溫度有關,溫度相同時Kw相同,溫度升高,促進水的電離,Kw增大,水的離子積只與溫度有關,與溶液的類型無關,可能為純水,也可能為酸、堿、鹽溶液,據此分析解答。
時的曲線上,水的Kw只與溫度有關,溫度相同時Kw相同,溫度升高,促進水的電離,Kw增大,水的離子積只與溫度有關,與溶液的類型無關,可能為純水,也可能為酸、堿、鹽溶液,據此分析解答。
A.由圖象可知,A、E、D都為![]() 時的曲線上,水的Kw只與溫度有關,溫度相同時Kw相同,溫度升高,促進水的電離,Kw增大,則
時的曲線上,水的Kw只與溫度有關,溫度相同時Kw相同,溫度升高,促進水的電離,Kw增大,則![]() ,由C點
,由C點![]() 可知,C點的Kw大于A點小于B,所以
可知,C點的Kw大于A點小于B,所以![]() ,故A正確;
,故A正確;
B.E點![]() ,溶液呈酸性,酸性條件下,
,溶液呈酸性,酸性條件下,![]() 、
、![]() 、
、![]() 、
、![]() 沒有沉淀、氣體、弱電解質、氧化還原反應產生,所以能共存,故B正確;
沒有沉淀、氣體、弱電解質、氧化還原反應產生,所以能共存,故B正確;
C.D點溶液中![]() ,溶液呈堿性,說明
,溶液呈堿性,說明![]() 的水解程度大于電離程度,所以
的水解程度大于電離程度,所以![]() ,故C錯誤;
,故C錯誤;
D.E點![]() ,溶液呈酸性,向
,溶液呈酸性,向![]() 溶液中滴入
溶液中滴入![]() 溶液,則溶液中反應:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正確;
溶液,則溶液中反應:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正確;
故選C。


 手拉手全優(yōu)練考卷系列答案
手拉手全優(yōu)練考卷系列答案科目:高中化學 來源: 題型:
【題目】下表是現行中學化學教科書中元素周期表的一部分,表中的每個編號表示一種元素,請根據要求回答問題。
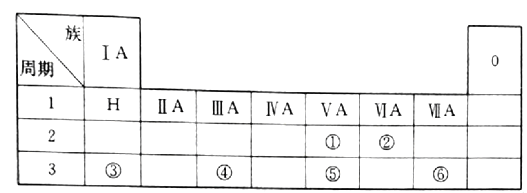
(1)② 表示的元素是______(填元素符號);
(2)①、⑤兩種元素的原子半徑大小為②______⑤(填“< ”或“>”);
(3)⑤所在元素周期表中的位置是_____________;
(4)寫出③與⑥兩種元素所形成化合物的化學式_________;
(5)④所表示元素的單質與③所表示元素的最高價氧化物的水化物在溶液中反應的離子方程式為:________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中,進行如下化學反應:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化學平衡常數K和溫度t的關系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列問題:
(1)該反應的化學平衡常數表達式為K=_____________。
(2)該反應為______反應(選填吸熱、放熱)。
升高溫度CO2的轉化將____________(填增大、減小或不變)。
(3)能判斷該反應是否達到化學平衡狀態(tài)的依據是______(多選扣分)。
a.容器中壓強不變 b.混合氣體中 c(CO)不變
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某溫度下,平衡濃度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),試判斷此時的溫度為______℃。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在室溫下,下列五種溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
請根據要求填寫下列空白:
(1)溶液①呈_____性(填“酸”、“堿”或“中”),其原因是________(用離子方程式表示)。
(2)比較②③溶液中,c(NH4+)的大小關系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 離子的濃度為0.1mol/L;NH3H2O和_____離子的物質的量濃度之和為0.2mol/L。
(4)室溫下,測得溶液②的pH=7,則CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-與NH4+濃度的大小關系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知HCN(aq)與NaOH(aq)反應生成1 mol正鹽的ΔH=-12.1 kJ/mol;強酸、強堿的稀溶液反應的中和熱ΔH=-57.3 kJ·mol-1。則HCN在水溶液中電離的ΔH等于( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含鐵化合物在生活生產中應用廣泛。如高鐵酸鹽(FeO42-)被科學家們公認為綠色消毒劑,在強堿性溶液中比較穩(wěn)定;聚合硫酸鐵則是一種高效絮凝劑。
(1)KClO與Fe(NO3)3飽和溶液反應可制備K2FeO4,兩種溶液的混合方式為____。
A.在攪拌下,將Fe(NO3)3飽和溶液緩慢滴加到KClO飽和溶液中
B.在攪拌下,將KClO飽和溶液緩慢滴加到Fe(NO3)3飽和溶液中
C.在攪拌下,將KClO飽和溶液和Fe(NO3)3飽和溶液一起加入
反應的離子方程式為______________________________。
(2)高鐵酸鹽有極強的氧化性,能迅速有效地去除淤泥中的臭味物質,自身被還原成新生態(tài)的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其濃度小于10-5 mol·L-1),需調節(jié)溶液的pH>____。
(3)聚合硫酸鐵[Fex(OH)y(SO4)z]的組成可通過下列實驗測定:
①稱取一定質量的聚合硫酸鐵配成100.00 mL溶液A;
②準確量取20.00 mL溶液A,加入鹽酸酸化的BaCl2溶液至沉淀完全,過濾、洗滌、干燥至恒重,得到白色固體11.65g;
③準確量取20.00 mL溶液A,加入足量銅粉,充分反應后過濾、洗滌,將濾液和洗液合并配成250.00 mL溶液B;
④準確量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至終點,消耗KMnO4溶液8.00 mL。
通過計算確定該聚合硫酸鐵的化學式(寫出計算過程)______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種元素,其中A元素和B元素的原子都有1個未成對電子,A+比B-少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子的p軌道中有3個未成對電子,其氣態(tài)氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數和為4,其最高價氧化物中含D的質量分數為 40%,且其核內質子數等于中子數。R是由A、D兩元素形成的離子化合物,其中A+與D2-離子數之比為2∶1。請回答下列問題:
(1)B-的電子排布式為__________,在CB3分子中C元素原子的原子軌道發(fā)生的是__________雜化。
(2)C的氫化物的空間構型為__________,其氫化物在同族元素所形成的氫化物中沸點最高的原因是__________。
(3)B元素的電負性__________D元素的電負性(填“>”、“<”或“=”),用一個化學方程式說明B、D兩元素形成的單質的氧化性強弱:__________。
(4)如圖所示是R形成的晶體的晶胞,設晶胞的棱長為a cm。 試計算R晶體的密度為__________。(阿伏加德羅常數用NA表示)
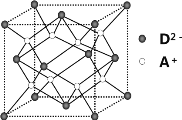
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關裝置圖的敘述中正確的是

A. 用裝置①給銅鍍銀,則b極為單質銀,電解質溶液為AgNO3溶液
B. 裝置②的總反應式:Cu + 2Fe3+ = Cu2+ + 2Fe2+
C. 裝置③中鋼閘門應與電源的負極相連被保護,該方法叫做外加電流的陰極保護法
D. 裝置④中插入海水中的鐵棒,越靠近底端腐蝕越嚴重
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com