
【題目】下表中實線是元素周期表的部分邊界,其中上邊界并未用實線標出。
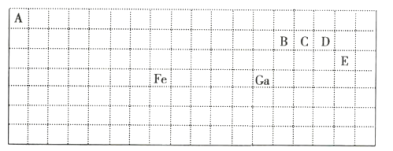
根據信息回答下列問題:
(1)基態Ga原子的最外層電子排布式為__。
(2)Fe元素位于周期表的__區;Fe與CO易形成配合物Fe(CO)5,在Fe(CO)5中鐵的化合價為__。與CO分子互為等電子體的分子為__(填化學式)。
(3)在CH4、CO、CH3OH中,碳原子采取sp3雜化的分子有__。
(4)ED4-的價電子對互斥理論模型為__。B、C、D、E中兩種原子相互結合形成的分子中,所有原子都滿足最外層8電子穩定結構的是__(寫2種,填化學式)。
【答案】4s24p1 d 0 N2 CH4、CH3OH 正四面體形 CO2、NCl3、CCl4(任寫2種)
【解析】
(1)根據元素周期表的結構,Ga是第四周期第IIIA族的元素,據此分析解答;
(2)根據元素周期表五區的劃分是根據最后排入的電子名稱命名的,結合Fe原子是26號元素,Fe原子的基態核外電子排布式為:1s22s22p63s23p63d64s2;Fe與CO易形成配合物Fe(CO)5,根據化合物的化合價代數和為0,CO是化合物,它的化合價的代數和是0,據此計算Fe(CO)5中鐵的化合價;根據等電子體的定義,只要原子數目和電子總數(或價電子總數)相同分析書寫CO的等電子體;
(3)根據價層電子對數=σ鍵電子對數+中心原子上的孤電子對數計算判斷;
(4)根據元素周期表知,A、B、C、D、E分別是H、C、N、O、Cl是五種元素,據此分析解答。
(1)元素周期表每一橫行是一個周期,一共有18個縱行,從左向右,1、2和13至17七個縱行是主族,且第一縱行開始分別為第IA族、第IIA族,第十三綜行開始為第IIIA族、第IVA族、第VA族、第IA族、第VIIA族,Ga是第四橫行第13縱行的元素,所以Ga是第四周期第IIIA族的元素,主族元素的族序數=其最外層電子數,所以Ga最外層有3個電子,最外層電子排布式為4s24p1,故答案為:4s24p1;
(2)元素周期表五區的劃分是根據最后排入的電子的軌道名稱命名的,Fe原子是26號元素,Fe原子的基態核外電子排布式為:1s22s22p63s23p63d64s2,
這些電子排列時遵循能量最低原理(先排能量低的后排能量高的),這些能級的能量大小順序為:1s<2s<2p<3s<3p<4s<3d,最后排入的是3d電子,屬于d區元素;根據化合物化合價的代數和為0,Fe與CO易形成配合物Fe(CO)5中CO的化合價的代數和為0,則鐵的化合價為0價;CO的等電子體必須是雙原子分子或離子,且電子總數相等,分子可以是N2,離子可以是CN-,故答案為:d;0;N2(或CN-);
(3)CH4中C的價層電子對數=σ鍵+中心原子上的孤電子對數= 4+0=4,所以碳原子采取sp3雜化;CO分子中價層電子對數=σ鍵+中心原子上的孤電子對數= 1+1=2,所以碳原子采取sp雜化;CH3OH中C的價層電子對數=σ鍵+中心原子上的孤電子對數=4+0=4,所以碳原子采取sp3雜化,故答案為:CH4、CH3OH;
(4)根據元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-離子,價層電子對數=σ鍵+中心原子上的孤電子對數=4+![]() =4,根據VSEPR理論預測ED4-離子的空間構型為正四面體型;根據元素周期表知,B、C、D、E分別是C、N、O、Cl是四種元素,分子中每個原子最外層都達到8電子穩定結構的化合物有:CO2、CCl4、NCl3等,故答案為:正四面體;CO2、CCl4、NCl3。
=4,根據VSEPR理論預測ED4-離子的空間構型為正四面體型;根據元素周期表知,B、C、D、E分別是C、N、O、Cl是四種元素,分子中每個原子最外層都達到8電子穩定結構的化合物有:CO2、CCl4、NCl3等,故答案為:正四面體;CO2、CCl4、NCl3。


科目:高中化學 來源: 題型:
【題目】常溫下,幾種弱電解質的pK(pK=-lgK)如下表所示:
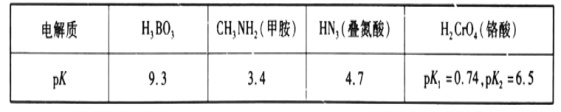
請回答下列問題:
(1)硼酸(H3BO3)在水中存在電離平衡:H3BO3+H2O![]() B(OH)4-+H+。由此推斷,硼酸是___(填字母)。
B(OH)4-+H+。由此推斷,硼酸是___(填字母)。
A.一元酸 B.三元酸 C.強酸 D.弱酸
(2)常溫下,在H3BO3、HN3、H2CrO4中酸性最強的是___(填化學式)。
(3)H2CrO4的二級電離常數表達式Ka2=___。
(4)甲胺在水中的電離和NH3類似,寫出CH3NH2在水中的電離方程式:___。
(5)常溫下,20mLpH=2的HN3溶液與xmLpH=12的NaOH溶液恰好完全反應,則x___(填“>”“<”或“=”)20mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,100 mL 1.0 mol/L Na2C2O4 溶液中加入足量pH=1的稀硫酸,再加入20 mL KMnO4溶液恰好完全反應。下列說法正確的是( )
A.Na2C2O4溶液中C2O42-數目為0.1N A
B.稀硫酸中水電離的c(H+)=0.1 mol/L
C.KMnO4溶液濃度為0.1 mol/L
D.反應過程中轉移電子數為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組探究SO2與Cu(OH)2懸濁液的反應。
實驗Ⅰ:向NaOH溶液中加入濃CuCl2溶液,制得含Cu(OH)2的懸濁液,測溶液pH≈13。向懸濁液中通入SO2,產生大量白色沉淀,測溶液pH≈3。推測白色沉淀中可能含有Cu+、Cu2+、Cl- 、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(藍色);Cu+![]() Cu(NH3)2+(無色);Cu+
Cu(NH3)2+(無色);Cu+![]() Cu+Cu2+
Cu+Cu2+
ii. Ag2SO4微溶于水,可溶于一定濃度的硝酸。
實驗Ⅱ:

(1)①通過“白色沉淀A”確定一定存在的離子是____________________。
②判斷白色沉淀中金屬離子僅含有Cu+、不含Cu2+的實驗證據是____________________。
③用以證實白色沉淀中無SO42-、SO32-、HSO3-的試劑a是____________________。
④生成CuCl的離子方程式是____________________。
(2)小組同學基于上述實驗認為: SO2與Cu(OH)2懸濁液能發生氧化還原反應不僅基于本身的性質,還受到“生成了沉淀促進了氧化還原反應的發生”的影響。設計實驗驗證了此觀點。
①用實驗Ⅰ方法制得含Cu(OH)2的懸濁液,過濾、洗滌獲取純凈的Cu(OH)2固體。檢驗Cu(OH)2固體是否洗滌干凈的方法是____________________。
編號 | 實驗 | 現象 |
III | 向Cu(OH)2固體中加入一定量的水,制得懸濁液(pH≈8),向懸濁液中通入SO2 | a. 底部產生少量淺黃色沉淀,慢慢消失 b. 靜置,底部產生少量紅色固體 |
IV | 向CuSO4溶液中通入SO2 | 無沉淀產生 |
②經確認淺黃色沉淀是CuOH,紅色固體是Cu,證明SO2與Cu(OH)2懸濁液發生了氧化還原反應。最終生成Cu的原因是____________________。
③由實驗III、IV可以得出的結論除“生成了沉淀促進了氧化還原反應的發生” 外還有____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在20 L的密閉容器中按物質的量之比1∶2充入CO和H2,發生反應CO(g)+2H2(g)CH3OH(g) ΔH。測得CO的轉化率隨溫度的變化及不同壓強下CO的變化如圖所示,p2和195 ℃時n(H2)隨時間的變化結果如下表所示。下列說法正確的是( )
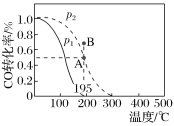
p2和195 ℃時n(H2)
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195 ℃時,0~3 min,反應速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.p1<p2,ΔH>0
C.195 ℃、p2時,在B點:v正>v逆
D.在p2和195 ℃時,該反應的平衡常數為25
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為超氧化鉀(KO2)晶體的一個晶胞,則下列有關說法正確的是( )
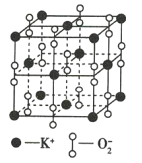
A.KO2中只存在離子鍵
B.每個晶胞中含有1個K+和1個O2-
C.晶體中與每個K+距離最近且相等的O2-有6個
D.晶體中所有原子之間都以離子鍵結合
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為CaF2、H3BO3(層狀結構,層內的H3BO3分子通過氫鍵結合)、金屬銅三種晶體的結構示意圖,請回答下列問題:
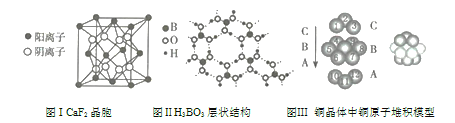
(1)圖I所示的CaF2晶胞中與Ca2+最近且等距離的F-的個數為____________。
(2)圖Ⅱ所示的物質結構中最外層已達8電子結構的原子是____________,H2BO3晶體中硼原子個數與極性鍵個數之比為____________。
(3)由圖Ⅲ所示的銅原子的堆積模型可知,未標號的銅原子形成晶體后其周圍最緊鄰的銅原子數為____________。
(4)三種晶體中熔點最低的是其晶體受熱熔化時,克服的微粒之間的相互作用為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,在實驗室中通常利用濃硫酸與乙醇混合加熱制乙烯,加熱一段時間后觀察到燒瓶中有黑色物質出現,(Ⅱ)中經稀硫酸酸化的高猛酸鉀溶液褪色。甲同學認為酸性高錳酸鉀溶液褪色,能證明乙烯被酸性高錳酸鉀溶液氧化了;乙同學認為酸性高錳酸鉀溶液褪色,不能證明乙烯被酸性高錳酸鉀溶液氧化了。
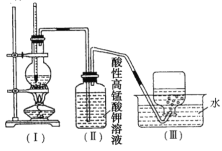
(1)____________(填“甲”或“乙”)同學的觀點正確,理由是_________(填序號)。
A.(Ⅱ)中酸性高錳酸鉀溶液褪色,能證明乙烯發生了氧化反應
B.(Ⅱ)中酸性高錳酸鉀溶液褪色,能證明乙烯發生了加成反應
C.(Ⅱ)中酸性高錳酸鉀溶液褪色,不能證明通入的氣體是純凈物
D.(Ⅱ)中酸性高錳酸鉀溶液褪色,只能證明通入的氣體一定具有還原性
(2)丙同學取(Ⅱ)中少量溶液于試管中,加入鹽酸和氯化鋇溶液,產生白色沉淀,據此他認為乙烯中一定混有二氧化硫,他的結論____(填“合理”或“不合理”),理由是________。若你認為不合理,請改進上述實驗方案,驗證乙烯中是否含有![]() ______。
______。
(3)丁同學對上述實驗方案進行了適當改進,用于驗證乙烯能否發生加成反應,則他的改進方法可能是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗方案能達到相應實驗目的的是( )
選項 | 實驗目的 | 實驗方案 |
A | 檢驗溴乙烷中的溴原子 | 加入 |
B | 檢驗溴乙烷發生了消去反應 | 加 |
C | 除去溴苯中的溴 | 用 |
D | 確定乙醇分子的結構 | 通過質譜儀進行質譜分析 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com