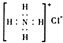【答案】
分析:A、氯原子最外層電子數為7,形成1對共用電子對,氧原子最外層電子數為6,形成2對共用電子對.
B、Fe原子失去4s能級的2個電子形成Fe
2+,Fe
2+離子質子數為26,核外電子數為24,有3個電子層,最外層電子數為14.
C、光氣COCl
2分子中碳原子與氧原子之間形成2對共用電子對,碳原子與氯原子之間形成1對共用電子對,碳原子連接2個氯原子.
D、sp
2雜化軌道由1個ns軌道和2個np軌道組合而形成的,每個雜化軌道含有三分之一的s軌道成分和三分之二p軌道成分,雜化軌道間夾角為120°,呈平面三角形.
解答:解:A、氯原子最外層電子數為7,形成1對共用電子對,氧原子最外層電子數為6,形成2對共用電子對,次氯酸分子中氧原子分別通過1對共用電子對與氯原子、氫原子結合,次氯酸結構式為H-O-Cl,故A錯誤;
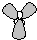
B、Fe原子失去4s能級的2個電子形成Fe
2+,Fe
2+離子質子數為26,核外電子數為24,有3個電子層,最外層電子數為14,Fe
2+離子結構示意圖為
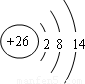
,故B錯誤;
C、光氣COCl
2分子中碳原子與氧原子之間形成2對共用電子對,碳原子連接2個氯原子,碳原子與氯原子之間形成1對共用電子對,COCl
2的結構式為
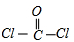
,故C錯誤;
氯離子質子數為17,核外電子數為18,有3個電子層,最外層電子數為8,氯離子結構示意圖為
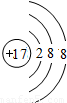
,C錯誤;
D、sp
2雜化軌道由1個ns軌道和2個np軌道組合而形成的,每個雜化軌道含有三分之一的s軌道成分和三分之二p軌道成分,雜化軌道間夾角為120°,呈平面三角形,sp
2雜化軌道模型
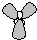
,故D正確.
故選:D.
點評:考查常用化學用語,難度中等,注意亞鐵離子的結構示意圖為易錯點,容易按能級順序失去電子,由基態到激發態按能層失去電子.

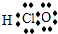
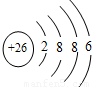
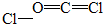
 ,故B錯誤;
,故B錯誤;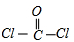 ,故C錯誤;
,故C錯誤; ,C錯誤;
,C錯誤; ,故D正確.
,故D正確.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案