
題目列表(包括答案和解析)
(12分)堿式碳酸銅[Cu2(OH)2C03]是一種用途廣泛的化工原料。工業上可用電子工業中刻蝕線路板的酸性廢液(主要成分有FeCl3、CuCl2、FeCl2)制備,其制備過程如下:
查閱資料知,通過調節溶液的酸堿性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物質 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 開始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
堿式碳酸銅是一種用途廣泛的化工原料。工業上可用酸性刻蝕廢液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制備,其制備過程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
|
物質 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
|
開始沉淀pH |
4.2 |
5.8 |
1.2 |
|
完全沉淀pH |
6.7 |
8.3 |
3.2 |
(1)氯酸鈉的作用是 ;濾渣的主要成分是 (寫化學式)。
(2)調節反應A后溶液的pH范圍應為 。可以選擇的試劑是 (填序號)。
a.氨水 b.稀硫酸 c.氫氧化鈉 d.碳酸銅
(3)反應B的溫度如過高,則所得藍綠色產品中可能會出現的雜質是 。(寫化學式)
(4)過濾得到的產品洗滌時,如何判斷產品已經洗凈? 。
(5)將Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。
① 若沉淀只有CuCO3,則相應的離子方程式為 。
② 若沉淀只有Cu(OH)2,用相應的離子方程式表示其過程 。
③ 若生成Cu(OH)2和CuCO3的混合物(即堿式鹽)。則說明 。
(6)堿式碳酸銅組成可表示為:aCuCO3•bCu(OH)2•cH2O,現通過下列方案測定其組成。步驟如下:
① 稱量樣品;② 高溫分解;③ 測出CO2的質量;④ 測出水蒸汽的質量;⑤ 稱量CuO。
請對上述測定方案作出評價。 。
堿式碳酸銅是一種用途廣泛的化工原料。工業上可用酸性刻蝕廢液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制備,其制備過程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
|
物 質 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
|
開始沉淀pH |
4.2 |
5.8 |
1.2 |
|
完全沉淀pH |
6.7 |
8.3 |
3.2 |
(1)濾渣的主要成分是 (寫化學式)。
(2)調節反應A后溶液的pH范圍應為 。選擇的試劑最合適的是 (填序號)。
a.氨水 b.稀硫酸 c.氫氧化鈉 d.碳酸銅
(3)反應B的溫度如過高,則所得藍綠色產品中可能會出現的雜質是 。
(4)將Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。用相應的離子方程式表示:
① 沉淀只有CuCO3: ;
② 沉淀只有Cu(OH)2 且放出氣泡: 。
(5)堿式碳酸銅的組成可表示為:aCuCO3•bCu(OH)2•cH2O。要測定其組成,甲同學設計的實驗方案中需要如下五個步驟:①稱量樣品的質量;②高溫分解;③測出CO2的質量;④測出水蒸汽的質量;⑤稱量CuO的質量。而乙同學認為除步驟②外,實驗只需測定四個量中的三個即可,則合理的組合為 (填序號,寫一組即可)。
堿式碳酸銅和氯氣都是用途廣泛的化工原料。
(1)工業上可用酸性刻蝕廢液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制備堿式碳酸銅,其制備過程如下: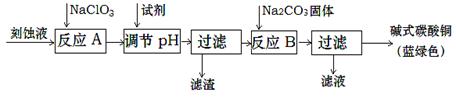
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物質 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 開始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |

堿式碳酸銅是一種用途廣泛的化工原料。工業上可用酸性刻蝕廢液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制備,其制備過程如下:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物 質 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 開始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com