
題目列表(包括答案和解析)
(09廣東卷).(分) 甲酸甲酯水解反應方程式為:
HCOOCH3(l)+H2O(l)![]() HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小組通過試驗研究該反應(反應過程中體積變化忽略不計)。反應體系中各組分的起始量如下表:
| 組分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物質的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯轉化率在溫度T1下隨反應時間(t)的變化如下圖:

(1)根據上述條件,計算不同時間范圍內甲酸甲酯的平均反應速率,結果見下表:
| 反應時間范圍/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反應速率/(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
請計算15-20min范圍內甲酸甲酯的減少量為 mol,甲酸甲酯的平均反應速率為 mol·min-1(不要求寫出計算過程)。
(2)依據以上數據,寫出該反應的反應速率在不同階段的變化規律及其原因: 。
(3)上述反應的平衡常數表達式為:![]() ,則該反應在溫度T1下的K值為 。
,則該反應在溫度T1下的K值為 。
(4)其他條件不變,僅改變溫度為T2(T2大于T1),在答題卡框圖中畫出溫度T2下甲酸甲酯轉化率隨反應時間變化的預期結果示意圖。
化學反應變化過程及結果的研究。按要求回答問題:
(1)關于反應過程中能量變化的研究:
則:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)關于反應速率和限度的研究:
工業生產尿素的原理是以NH3和CO2為原料合成尿素[CO(NH2)2],反應的化學方程式為:
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),該反應的平衡常數(K)和溫度(T / ℃)關系如下:
CO(NH2)2 (l) + H2O (l),該反應的平衡常數(K)和溫度(T / ℃)關系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
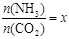 ,下圖(1)是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。
,下圖(1)是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。

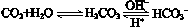 ,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:
,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |

 CO(NH2)2 (l) + H2O (l),該反應的平衡常數(K)和溫度(T / ℃)關系如下:
CO(NH2)2 (l) + H2O (l),該反應的平衡常數(K)和溫度(T / ℃)關系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 ,下圖(1)是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。
,下圖(1)是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。


 ,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:
,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
化學反應變化過程及結果的研究。按要求回答問題:
(1)關于反應過程中能量變化的研究:

則:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)關于反應速率和限度的研究:
工業生產尿素的原理是以NH3和CO2為原料合成尿素[CO(NH2)2],反應的化學方程式為:
2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l),該反應的平衡常數(K)和溫度(T / ℃)關系如下:
CO(NH2)2
(l) + H2O (l),該反應的平衡常數(K)和溫度(T / ℃)關系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓變ΔH _______0 (填“>”、“<”或“=”)。
②在一定溫度和壓強下,若原料氣中的NH3和CO2的物質的量之比(氨碳比) ,下圖(1)是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。
,下圖(1)是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。

③上圖中的B點處,NH3的平衡轉化率為 。
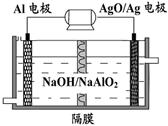
(3)關于電化學的研究:
鋁是日常生活中用途最多的金屬元素,下圖為Al-AgO電池的構造簡圖,電解質溶液為NaOH,它可用作水下動力電源,該電池中鋁電極反應式為 。用該電池電解尿素[CO(NH2)2]的堿性溶液制氫的裝置示意圖如下圖(電解池中隔膜僅阻止氣體通過,陰、陽極均為惰性電極)。電解時,陽極的電極反應式為 。


(4)關于電離平衡的研究:
人體血液里存在重要的酸堿平衡: ,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:
,使人體血液pH保持在7.35~7.45,否則就會發生酸中毒或堿中毒。其pH隨c(HCO3-)∶c(H2CO3)變化關系如下表:
|
c(HCO3-) ∶c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
|
pH |
6.10 |
7.35 |
7.40 |
7.45 |
試回答:
正常人體血液中,HCO3-的水解程度 電離程度(填“大于”、“小于”、“等于”);
②人體血液酸中毒時,可注射緩解 (填選項);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③ pH=7.00的血液中,c(H2CO3) c(HCO3-) (填“<”、“>”、“=”)
目前,“低碳經濟”備受關注,CO2的產生及有效開發利用成為科學家研究的重要課題。試運用所學知識,解決下列問題:
(1)已知某反應的平衡表達式為: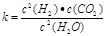 它所對應的化學反應為:__ ___
它所對應的化學反應為:__ ___
(2)—定條件下,將C(s)和H2O(g)分別加入甲、乙兩個密閉容器中,發生(1)中反應:其相關數據如下表所示:
| 容器 | 容積/L | 溫度/℃ | 起始量/mol | 平衡量/mol[ | 達到平衡所需時間/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1,2 | 3 |
 CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)| 投料比[n(H2)/ n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com