現有一瓶未開啟的濃硫酸,試劑瓶標簽上的部分內容如圖所示.請根據有關信息計算:

(1)該試劑中硫酸溶液的質量是
g.工人小李用該濃硫酸配制20%的稀硫酸,以清洗鋼鐵表面的鐵銹.他在配制該溶液時所用98%的濃硫酸與水的質量比應該為
.
(2)某固體物質由氯化鈉和氯化鋇混合組成,取32.8g該固體混合物完全溶于水,并逐滴加入上述20%的稀硫酸,產生沉淀的質量與加入稀硫酸的質量有如下圖所示關系,計算32.8g固體混合物中氯化鋇和氯化鈉的質量.
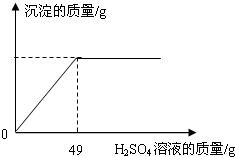
(3)若加入的稀硫酸剛好使沉淀最大量時,將所得混合物過濾、洗滌,得濾液200g(過程中損耗忽略不計),計算該濾液中溶質HCl的質量分數.(若溶液中含有多種溶質,則某溶質的質量分數為該溶質的質量與溶液總質量之比)
(反應的方程是為:BaCl
2+H
2SO
4=BaSO
4↓+2HCl)(注:(2)、(3)兩問將計算過程寫在答卷紙上)


