
題目列表(包括答案和解析)
化學中質量守恒定律是一個非常重要的定量定律.
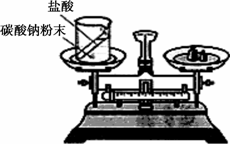
(1)如圖裝置中,稱量小燒杯中所有物質的質量m1,然后將小燒杯中的碳酸鈉與鹽酸完全混合,反應發生一段時間后,再稱量小燒杯及燒瓶內物質的總質量為m2,則(填“=”“>”“<”)m1________m2,其原因為________.
(2)天然氣的主要成分是甲烷(CH4),可直接用作氣體燃料.燃燒反應前后分子種類變化的微觀示意圖如下所示.

①1個B分子中含有________個原子.
②四種物質中屬于化合物的是________(填圖中字母).
(3)A和B可發生如下反應:3A+2B=A3B2,某學生做了3次該實驗(每次均充分反應),反應前A和B的質量和都是10 g.有關實驗數據見下表:
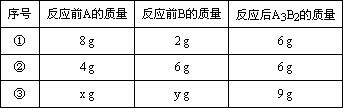
X∶Y的比值可能為________或________.
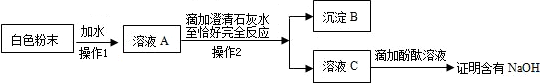
(4)為了測定某品牌食用純堿中碳酸鈉的質量分數,某校化學研究性學習小組的探究過程如下:
[提出問題]樣品中碳酸鈉的質量分數是多少?
[知識準備]食用純堿的主要成分是碳酸鈉,另外還含有少量的氯化鈉;反應過程中不考慮水和氯化氫的揮發.
[設計方案](1)方案一:向一定量樣品中加入過量澄清石灰水,根據反應生成碳酸鈣的質量,先求出碳酸鈉的質量,再計算樣品中碳酸鈉的質量分數.
(2)方案二:向一定量樣品中加入足量的稀鹽酸,根據反應生成二氧化碳的質量,先求出碳酸鈉的質量,再計算樣品中碳酸鈉的質量分數.
[進行實驗]甲組同學:稱取24.00 g樣品,加水配成溶液,在溶液中加入過量的澄清石灰水.過濾、洗滌、干燥,共得到白色沉淀20.00 g.
乙組同學:稱取24.00 g樣品,加入足量的稀鹽酸直到反應停止,共收集到8.80 g二氧化碳.
[解決問題]請你任選一組同學的實驗結果,幫助他們計算出樣品中碳酸鈉的質量分數.(寫出計算過程.計算結果精確到0.1%)
________.
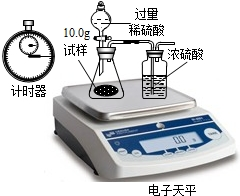
| 稱 量 項 目 | 稱 量 時 間 | 質量(g) |
| 試樣 | 10.00 | |
| 裝置+稀硫酸質量 | 241.30 | |
| 裝置+稀硫酸質量+試樣 | 反應開始后15秒 | 249.20 |
| 裝置+稀硫酸質量+試樣 | 反應開始后35秒 | 248.20 |
| 裝置+稀硫酸質量+試樣 | 反應開始后55秒 | 248.00 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com